
| A. | F-的结构示意图: | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 氮气的电子式: | |
| D. | 乙烯的结构简式:CH2CH2 |
分析 A.氟离子质子数为9,核外电子数为10,最外层有8个电子;
B.元素符合的左下角数字表示质子数,左上角数字表示质量数,质量数=质子数+中子数;
C.氮气中存在三对共用电子对,N未满足8电子稳定结构;
D.乙烯的分子式为C2H4,含有1个C=C键.
解答 解:A.氟离子质子数为9,最外层有8个电子,F-的结构示意图: ,故A错误;
,故A错误;
B.元素符合的左下角数字表示质子数,左上角数字表示质量数,所以质子数为8,中子数为10的氧原子质量数=质子数+中子数=8+10=18,符号为:${\;}_{8}^{18}$O,故B正确;
C.氮气的电子式为 ,故C错误;
,故C错误;
D.乙烯的分子式为C2H4,含有1个C=C键,乙烯的结构简式为CH2=CH2,故D错误;
故选B.
点评 本题考查化学用语,涉及离子结构示意图、电子式、结构简式等,注意乙烯的结构简式存在C=C键为解答的易错点,把握化学用语的规范使用,题目难度不大.


科目:高中化学 来源: 题型:实验题
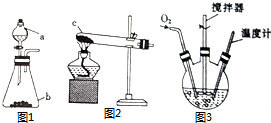 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

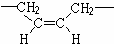 ,若顺丁橡胶的平均相对分子质量为540108,则平均聚合度为10002.
,若顺丁橡胶的平均相对分子质量为540108,则平均聚合度为10002.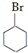 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$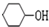 +NaBr.
+NaBr.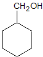 的合成路线.
的合成路线.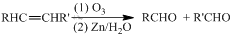 (R,R’代表烃基或氢)CH2=CHCH=CH2$\stackrel{催化剂}{→}$
(R,R’代表烃基或氢)CH2=CHCH=CH2$\stackrel{催化剂}{→}$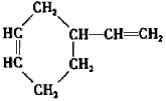

 $→_{催化剂}^{氢气}$
$→_{催化剂}^{氢气}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
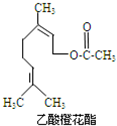 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ①②⑤⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能在空气中燃烧 | |
| B. | 都容易发生取代反应 | |
| C. | 苯和乙烯都能在一定条件下发生加成反应 | |
| D. | 苯不能使酸性KMnO4溶液褪色而乙烯能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )| A. | 构成原电池时b极反应为Cu2++2e-═Cu | |
| B. | 构成电解池时a极质量一定减少 | |
| C. | 构成电解池时b极质量可能减少也可能增加 | |
| D. | 构成的原电池或电解池工作后可能产生大量气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
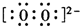 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com