
【题目】下列实验误差分析错误的是( )
A.用湿润的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.容量瓶中含有少量蒸馏水对所配的溶液无影响
D.测定中和反应的中和热时,保温效果越好,测定误差越小
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2L的恒容密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A.乙容器中,平衡时,反应放出的热量为32.8kJB.T1时,反应的平衡常数K乙=1
C.平衡时,乙中CO的浓度是甲中的2倍D.乙容器中,平衡时H2O的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗HIV、抗肿瘤、抗真菌和延缓心血管老化的活性苯并呋喃衍生物(R)的合成路线如下:
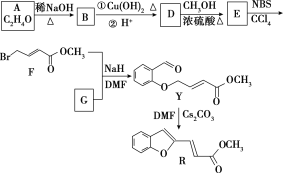
已知:RCHO+R1CH2CHO![]()
![]() +H2O(R、R1表示烃基或氢)
+H2O(R、R1表示烃基或氢)
(1)①A的名称是________。
②D―→E的反应类型是________。
③F中含有的官能团有酯基、________和________(写名称)。
④写出F与足量NaOH溶液共热反应的化学方程式___________。
(2)物质G可通过如下流程合成:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
1.08 g的I与饱和溴水完全反应,生成2.66 g白色沉淀,则I的结构简式为_________写出M―→G中反应①的化学方程式______________________。
(3)下列说法正确的是________(选填字母)。
a.Y易溶于水
b.B能使酸性高锰酸钾溶液褪色
c.R的分子式为C12H10O3
d.I与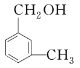 互为同系物
互为同系物
(4)写出符合下列要求的E的同分异构体的结构简式:____(写反式结构)。
①与E具有相同官能团 ②能发生银镜反应 ③有2个-CH3 ④存在顺反异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+ O2(g)2SO3(g);H=-196.64kJmol-1,下列说法正确的是( )
A.该反应是吸热反应
B.SO2燃烧热为196.64kJmol-1
C.在容器中充入1molSO2和0.5molO2充分反应,热变化为98.32kJ
D.当有NA个电子发生转移时,热变化为49.16kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 实验室欲用NaOH固体配制
实验室欲用NaOH固体配制![]() 的NaOH溶液
的NaOH溶液![]() 。
。
①本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、250mL容量瓶、还有_________;
②要完成本实验该同学应称出____________![]() ;
;
③若直接在天平的两个托盘上放两张质量相等的纸片进行称量,则会使得配制结果_______。![]() 偏低、偏高或无影响
偏低、偏高或无影响![]()
![]() 铁不能与冷、热水反应,但能与水蒸气反应。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
铁不能与冷、热水反应,但能与水蒸气反应。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当_________时![]() 填实验现象
填实验现象![]() ,说明“铁与水蒸气”能够进行反应;
,说明“铁与水蒸气”能够进行反应;
②写出该反应的化学方程式,并用单线桥表示出电子转移情况___________;
③为了研究一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积![]() 已折算成标准状况
已折算成标准状况![]() 。收集并测量气体体积应选下图中的________装置;
。收集并测量气体体积应选下图中的________装置;

若称取![]() 铁粉,然后与水蒸气加热至无气体放出,最好选用__________规格的量筒
铁粉,然后与水蒸气加热至无气体放出,最好选用__________规格的量筒![]() 选填字母序号
选填字母序号![]() 。
。
A.100mL B.200mL C.500mL D.1000mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_____。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_________________。
②同学们在两烧杯中还观察到以下现象。其中,属于盛放Na2CO3的烧杯中出现的现象的是______(填字母序号)。
a.溶液温度下降 b.溶液温度升高 c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,__________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mLNa2CO3溶液中滴加1mL 0.5mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32—浓度较大,能与CaCl2发生反应______________(写离子方程式) |
操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32—浓度很小,不能与CaCl2反应 |
实际实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
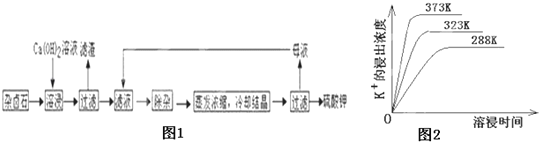
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com