
| A. | ①④⑥ | B. | ②③⑤⑥ | C. | ②④⑥⑦ | D. | ①②③④⑤⑥⑦ |
分析 ①FeCl3溶液与Cu的反应是利用铁离子的氧化性氧化铜反应生成氯化亚铁和氯化铜;
②氯化铁水解生成氢氧化铁和氯化氢,FeCl3溶液加热蒸干,氯化氢挥发,水解平衡正向进行,得到氢氧化铁灼烧得到氧化铁;
③FeCl3溶液与KI的反应是利用氯化铁具有氧化性氧化碘离子为碘单质;
④饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体,是利用氯化铁水解加热促进生成;
⑤FeCl3溶液与H2S 的反应利用氯化铁具有氧化性氧化硫化氢具有还性生成硫单质;
⑥FeCl3溶液与NaHCO3溶液的反应是铁离子和碳酸氢根离子发生双水解;
⑦配制FeCl3溶液需加入一定量的盐酸,氯化铁水解显酸性,加入盐酸抑制水解.
解答 解:①FeCl3溶液与Cu的反应是利用铁离子的氧化性氧化铜反应生成氯化亚铁和氯化铜,与氧化还原有关而与水解无关,故不选;
②氯化铁水解生成氢氧化铁和氯化氢,FeCl3溶液加热蒸干,氯化氢挥发,水解平衡正向进行,得到氢氧化铁灼烧得到氧化铁,与水解有关,故选;
③FeCl3溶液与KI的反应是利用氯化铁具有氧化性氧化碘离子为碘单质,与氧化还原有关而与水解无关,故不选;
④饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体,是利用氯化铁水解加热促进生成,与水解有关,故选;
⑤FeCl3溶液与H2S 的反应利用氯化铁具有氧化性氧化硫化氢具有还性生成硫单质,与氧化还原有关而与水解无关,故不选;
⑥FeCl3溶液与NaHCO3溶液的反应是铁离子和碳酸氢根离子发生双水解,与水解有关,故选;
⑦配制FeCl3溶液需加入一定量的盐酸,氯化铁水解显酸性,加入盐酸抑制水解,与水解有关,故选.
故选C.
点评 本题考查了盐类水解的分析判断,掌握基础是关键,注意铁离子的氧化还原反应分析,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NH4Cl溶液与0.05mol/L NaOH溶液等体积混合后所得的碱性溶液中:c(Cl-)>c(Na+)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+) | |
| C. | 等物质的量的NaClO、NaHCO5混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
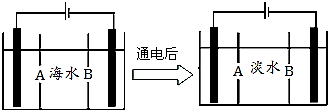 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用18.4mol•L-1的浓H2SO4配制100mL浓度为1mol•L-1的稀H2SO4,其操作可分为以下各步:
用18.4mol•L-1的浓H2SO4配制100mL浓度为1mol•L-1的稀H2SO4,其操作可分为以下各步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
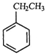 (g)+CO2(g)?
(g)+CO2(g)?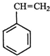 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)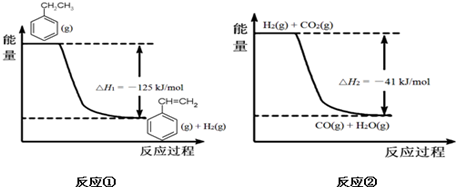
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ ,该聚合物的链节为
,该聚合物的链节为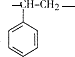 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| C. | 氨水与FeCl3溶液反应:3OH-+Fe3+═Fe(OH)3↓ | |
| D. | NaOH与盐酸反应:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
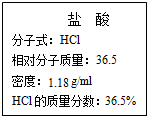 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com