分析:Ⅰ此题实质上是分析发生的连续反应的分段情况.
2NaHCO
3 Na
2CO
3+H
2O+CO
2 ①
2Na
2O
2+2CO
2=2Na
2CO
3+O
2 ②
2Na
2O
2+2H
2O=4NaOH+O
2 ③
当发生反应①、②且完全反应时,则有Na
2CO
3、H
2O和O
2,
=;若Na
2O
2不足,则CO
2有剩余,则
<
.
当发生反应①、②、③且完全反应时,a=b,
=1,有Na
2CO
3、NaOH和O
2;若Na
2O
2不足以与水完全反应,则水蒸气有剩余,
<1;若Na
2O
2有剩余,则
>1.
Ⅱ铝粉和铁粉的混合物与一定量很稀HNO
3充分反应,被氧化为Al
3+、Fe
3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH
4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H
++OH
-=H
2O,
②Fe
3++3OH
-=Fe(OH)
3↓,Al
3++3OH
-=Al(OH)
3↓,
③NH
4++OH
-═NH
3?H
2O,
④Al(OH)
3 +OH
-=AlO
2-+2H
2O
(1)D与E一段沉淀的质量没有发生变化,为NH
4NO
3和NaOH反应,E与F之间沉淀的量减少,为Al(OH)
3溶解在氢氧化钠溶液中,以此书写离子方程式;
(2)根据曲线的变化判断出各段反应,根据消耗的氢氧化钠的体积和反应方程式计算反应后溶液含有铁离子和铝离子的物质的量,再根据原子守恒计算铝和铁的质量;
(3)根据E点溶液中的溶质结合原子守恒计算硝酸的物质的量浓度;
(4)根据消耗NaOH的总体积,结合在D点氢氧化钠与硝酸、铝铁离子的反应,可计算得出C点氢氧化钠溶液的体积.
解答:解:(1)当剩余固体只有碳酸钠时,则过氧化钠恰好和二氧化碳完全反应,发生的反应方程式为2NaHCO
3+Na
2O
2 2Na
2CO
3+H
2O+
O
2,所以排出气体中O
2的物质的量是过氧化钠的一半为
mol,故答案为:
mol;
(2)当
>1时,发生的化学反应为2NaHCO
3+2Na
2O
2 2Na
2CO
3+2NaOH+O
2,过氧化钠有剩余,碳酸氢钠分解生成的二氧化碳和水完全反应,固体中含有Na
2CO
3、NaOH、Na
2O
2,排出气体为O
2,故答案为:Na
2CO
3、NaOH、Na
2O
2;排出气体为O
2;
(3)当剩余固体为Na
2CO
3,NaOH,排出气体为O
2,H
2O时,说明过氧化钠、二氧化碳完全反应,水部分反应,发生的反应是①②③,则
的值为
<<1,故答案为:
<<1;
(4)2NaHCO
3 Na
2CO
3+H
2O+CO
2 ①
2 1 1
b
2Na
2O
2+2CO
2=2Na
2CO
3+O
2 ②
2 2 1
2Na
2O
2+2H
2O=4NaOH+O
2 ③
2 2 1
x x
排出的水为
-x,氧气的量为
+,当排出的O
2和H
2O为等物质的量时,则
-x=
+,x=
,所以a=
+x=+=,所以
=
=,故答案为:
;
Ⅱ铝粉和铁粉的混合物与一定量很稀HNO
3充分反应,被氧化为Al
3+、Fe
3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH
4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H
++OH
-=H
2O,
②Fe
3++3OH
-=Fe(OH)
3↓,Al
3++3OH
-=Al(OH)
3↓,
③NH
4++OH
-═NH
3?H
2O,
④Al(OH)
3 +OH
-=AlO
2-+2H
2O
(1)D与E一段沉淀的质量没有发生变化,为NH
4NO
3和NaOH反应,反应的离子方程式为,NH
4++OH
-═NH
3?H
2O,
E与F之间沉淀的量减少,肯定是因为Al(OH)
3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)
3+OH
-=AlO
2-+2H
2O
故答案为:NH
4++OH
-═NH
3?H
2O;Al(OH)
3+OH
-=AlO
2-+2H
2O;
(2)E与F之间沉淀的量减少,为Al(OH)
3溶解在氢氧化钠溶液中,
其反应方程式为Al(OH)
3+NaOH=NaAlO
2+2H
2O,
氢氧化铝与氢氧化钠物质的量之比为1:1,
EF段的n(NaOH)=4mol/L×2×10
-3L=0.008mol,
Al-----Al(OH)
3----NaOH→NaAlO
2+2H
2O
27g 1mol
0.216g 0.008mol
所以铝的质量是0.216g;
D与E一段氢氧化钠被消耗,
但没有和氢氧化铝反应,从题干中可以知道
硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵.
DE段分析如下,是NH
4NO
3和NaOH反应
NH
4NO
3~NaOH
1 mol 1mol
n(NH
4NO
3)=n(NaOH)=(34-31)×10
-3L×4mol/L=0.012mol 所以铁和铝开始和硝酸反应的时候生成三价离子,N元素变成铵根离子
铁离子和铝离子失去3e,N元素从+5变成-3价得8e
设铁有xmol,Al离子也是0.008mol,NH
4+有0.012mol,根据电子守恒可得:
3x+0.008×3=0.012×8
x=0.024mol,
所以铁离子有0.024mol,根据原子守恒知,铁的物质的量是0.024mol,其质量=0.024mol×56g/mol=1.344g,
故答案为:0.216;1.344;
(3)E点时,溶液中的溶质是硝酸钠和氨水,n(NH
3?H
2O )=n(NH
4+)=0.012mol,n(NaNO
3)=n(NaOH)=34×10
-3L×4mol/L=0.136mol,根据氮原子守恒知,C(HNO
3)=
=
=1.48mol/L,故答案为:1.48;
(4)滴加NaOH体积为31ml时,
发生反应为①H
++OH
-=H
2O,②Fe
3++3OH
-=Fe(OH)
3↓,Al
3++3OH
-=Al(OH)
3↓,
可计算得出C点氢氧化钠溶液的体积为
31ml-
×10
3ml/L=7mL.
故答案为:7.

 (2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.

 (2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
(2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )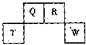 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:







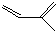
 的分子式为
的分子式为

 以及必要的无机试剂可合成
以及必要的无机试剂可合成 ,写出第一步合成反应的化学方程式
,写出第一步合成反应的化学方程式

 的一种同分异构体A,它的一氯代物有三种.与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为
的一种同分异构体A,它的一氯代物有三种.与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为

 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.


 )是一种医药中间体.
)是一种医药中间体.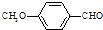 )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内.并写出茴香醛与银氨溶液反应的化学方程式.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内.并写出茴香醛与银氨溶液反应的化学方程式.



