某电镀铜厂有两种废水需要处理,一种废水中含有CN
-离子,另一种废水中含有Cr
2O
72-离子.该厂拟定如图所示的废水处理流程.
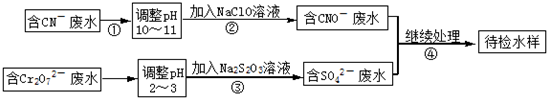
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN
-+bClO
-+2cOH
-=dCNO
-+eN
2↑+fCO
32-+bCl
-+cH
2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e:f的值为
(填选项标号).
A.1 B.
C.2 D.不能确定
②若d=e=1,则b=
.
若反应中转移0.6mol电子,则生成的气体在标况下的体积是
.
(2)步骤③中反应时,每0.4molCr
2O
72-转移2.4mol的电子,该反应的离子方程式为
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na
2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因.
①产生蓝色沉淀的离子方程式为
,②后又变黑色沉淀的离子方程式为
.
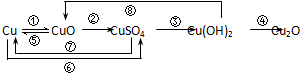
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu
2+稳定,Cu
+易在酸性条件下发生;2Cu
+=Cu+Cu
2+.大多数+1价铜的化合物是难溶物,如:Cu
2O、CuI、CuCl、CuH等.
①写出CuH在过量稀盐酸中有气体生成的离子方程式
.
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式:
CuH+
HNO
3--
Cu(NO
3)
2+
H
2↑+
+
.




 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
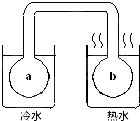 如图所示,密封双球体系中充有红棕色气体X.将左右烧杯中水浴造成温差后,发现a中气体颜色比b中气体的颜色深(不考虑气体液化),则X可能是( )
如图所示,密封双球体系中充有红棕色气体X.将左右烧杯中水浴造成温差后,发现a中气体颜色比b中气体的颜色深(不考虑气体液化),则X可能是( )