5.乙硫醇(C
2H
5SH)在生活生产中有重要的应用.
(1)工业上利用H
2S和乙烯反应合成乙硫醇的反应及可能发生的副反应如下:
主反应:C
2H
4(g)+H
2S(g)═C
2H
5SH(g)△H
1=a kJ•mol
-1副反应:2C
2H
4(g)+H
2S(g)═C
2H
5SC
2H
5(g)△H
2=b kJ•mol
-1请写出C
2H
5SH(g)在一定条件下直接转化为C
2H
5SC
2H
5(g)的热化学方程式2C
2H
5SH(g)=C
2H
5SC
2H
5(g)+H
2S(g)△H=(b-2a) kJ•mol
-1.
(2)投料比n(C
2H
4):n(H
2S)=1:3时,在240℃、1.8MPa下,催化剂甲和催化剂乙对合成乙硫醇的催化活性随MoO
3负载量的变化如图所示(已知适量CoO的加入有助于MoO
3在γ-Al
2O
3载体上的
分散.):
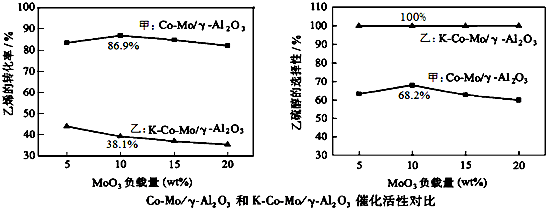
①工业上较宜选用的催化剂为催化剂乙,请说明你选择的理由,并推测工业上解决存在问题的方法:使用乙为催化剂,乙硫醇的选择性为100%,没有副产物,不必分离提纯;转化率较低,工业上可以通过循环使用来提高乙烯的利用率.
②若选用甲为催化剂,MoO
3的适宜负载量为10wt%,当MoO
3负载量(即质量分数)过低时,乙烯的转化率和乙硫醇的选择性均明显较低,原因为MoO
3负载量低,在γ-Al
2O
3载体上过于分散,催化活性低.
③若选用乙为催化剂,当MoO
3负载量为10wt%,若用平衡分压代替平衡浓度,主反应的平衡常数Kp=Kp=$\frac{\frac{0.682}{4-0.682}×1.8}{\frac{3-0.682}{4-0.682}×1.8×\frac{1-0.682}{4-0.682}×1.8}$=$\frac{0.682×3.318}{(3-0.682)×(1-0.682)×1.8}$.(带入数据列式即可,已知:分压=总压×物质的量分数)
④为了提高乙烯的转化率,工业上还可能采用的措施有适当提高H
2S的比例,适当增加压强,及时分离出产物等(任写一种).
(3)乙硫醇可用于生产乙烷磺酰氯(C
2H
5SO
2Cl).
①氯化法是以C
2H
5SO
2Cl为介质,搅拌下C
2H
5SH、水、氯气在29℃左右反应制得.反应的化学方程式为C
2H
5SH+3Cl
2+2H
2O→C
2H
5SO
2Cl+5HCl.
②电解C
2H
5SH的盐酸溶液也可制得C
2H
5SO
2Cl,电极总反应为C
2H
5SH+HCl+H
2O→C
2H
5SO
2Cl+H
2↑(未配平).则阴极的电极反应式为2H
++2e
-=H
2↑.

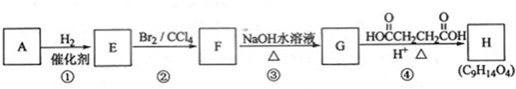
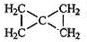
 、醛基-CHO、羧基-COOH.
、醛基-CHO、羧基-COOH. 
 ;
;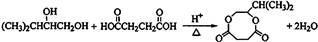 ;
; .
.