
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是
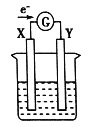
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. 若两电极都是金属,则它们的活泼性为X>Y
D. X极上发生的是还原反应,Y极上发生的是氧化反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】稀有气体的化学性质非常稳定,很难发生化学反应,所以曾被称为“惰性气体”,但这种化学惰性是相对的,例如:在一定体积的容器中,加入1.5molXe气和7.5molF2气,于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5molF2气。则所得无色晶体产物中,氙与氟的原子个数比是
A.1:2
B.1:3
C.1:4
D.1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究: 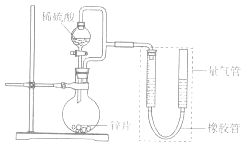
(1)用上述装置探究影响化学反应速率的因素.以生成9.0mL气体为计时终点,结果为t1>t2 .
序号 | V(H2SO4)/mL | C(H2SO4)/molL﹣1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是 .
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号).
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀 ①圆底烧瓶中的试剂可选用(填序号)
A.稀HCl B.NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项实验操作中,正确的是( )
A.用酒精萃取溴水中溴单质的操作可选用分液漏斗,而后静置分液
B.溶解固体时烧杯在使用前必须干燥
C.萃取、分液前需对分液漏斗检漏
D.蒸馏操作时,可以用温度计搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中c(Cl-)与50 mL 1 mol·L-1 AlCl3溶液中c(Cl-)相等的是 ( )
A. 150 mL 1 mol·L-1的NaCl溶液 B. 75 mL 3 mol·L-1 MgCl2溶液
C. 150 mL 2 mol·L-1的KCl溶液 D. 75 mL 1 mol·L-1的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A. ![]() N2H4(g)+
N2H4(g)+![]() O2(g) ===
O2(g) ===![]() N2(g)+H2O(g)ΔH=+267 kJ·mol-1
N2(g)+H2O(g)ΔH=+267 kJ·mol-1
B. N2H4(g)+O2(g) === N2(g)+2H2O(l)ΔH=-133.5 kJ·mol-1
C. N2H4(g)+O2(g) === N2(g)+2H2O(g)ΔH=+534 kJ·mol-1
D. N2H4(g)+O2(g) === N2(g)+2H2O(g)ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)Li4Ti3O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe TiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为 . 
(2)“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .
(3)TiO2xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2xH2O转化率最高的原因 .
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 .
(5)若“滤液②”中c(Mg2+)=0.02molL﹣1 , 加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10﹣5 , 此时是否有Mg3(PO4)2沉淀生成?(列式计算).FePO4、Mg3(PO4)2的分别为1.3×10﹣22、1.0×10﹣24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com