
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应,A是常见的金属单质,D是无色气体单质、F是黄绿色气态单质,反应①②均在水溶液中进行的.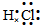 ,
,分析 F是黄绿色气态单质,为Cl2,由反应①A+B→C+D,D+Cl2→B,结合A是常见的金属单质,D是无色气体单质,反应①是置换反应,考虑反应①是金属与酸发生的置换反应,故D为H2,B为HCl,C含有金属A的元素,由C$\stackrel{Cl_{2}}{→}$E,A$\stackrel{Cl_{2}}{→}$E可知,A为变价金属,故A为Fe,C为FeCl2,E为FeCl3,验证符合转化关系.
解答 解:是黄绿色气态单质,为Cl2,由反应①A+B→C+D,D+Cl2→B,结合A是常见的金属单质,D是无色气体单质,反应①是置换反应,考虑反应①是金属与酸发生的置换反应,故D为H2,B为HCl,C含有金属A的元素,由C$\stackrel{Cl_{2}}{→}$E,A$\stackrel{Cl_{2}}{→}$E可知,A为变价金属,故A为Fe,C为FeCl2,E为FeCl3,
(1)B为HCl,氯原子与氢原子之间形成1对共用电子对,电子式为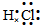 ,故答案为:
,故答案为: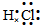 ;
;
(2)反应①是铁与盐酸反应生成氯化亚铁与氢气,反应方程式为:Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(3)FeCl3的水溶液中Fe3+离子水解Fe3++3H2O?Fe(OH)3+3H+,溶液呈酸性,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(4)C为FeCl2,保存FeCl2的水溶液时,要防止其被氧化,一般的做法是在FeCl2溶液中加入少量铁粉,故答案为:在FeCl2溶液中加入少量铁粉.
点评 本题以无机框图题的形式考查Fe、Cl等元素单质及其化合物之间的相互转化关系、热化学方程式等化学用语的书写,本题中F是黄绿色气态单质,反应①是置换反应,A是常见的金属单质,D是无色气体单质等均为解题突破口,难度不大


科目:高中化学 来源: 题型:推断题
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{m}{VM}$ | B. | m=ρVM | C. | W%=$\frac{cM}{1000p}$% | D. | c=$\frac{1000ρW%}{M}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 杂质 | 加入试剂 | 化学方程式 |
| 硫酸盐 | ||
| MgCl2 | ||
| CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用干布擦,后边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 酒精在实验台上燃烧时,用水扑灭火焰 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点/℃ | 沸点/℃ | 水溶性 |
| (CN)2 | -34 | -21.2 | 可溶 |
| Cl2 | -101 | -34 | 可溶 |
| A. | 二者均为非金属单质 | |
| B. | 标况下,氰的体积大于氯气的体积 | |
| C. | 同温同压下,相同质量的氰和氯气,前者含有的原子多 | |
| D. | 标况下,氰与氯气的密度之比为71:52 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的相对分子质量是98g/mol | |
| B. | 1molH2SO4的质量是98g | |
| C. | 1molH2SO4中含有1molH2 | |
| D. | 1molH2SO4中共含有6.02×1023个原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com