
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
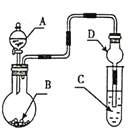
A. 若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B. 实验仪器D可以起到防止溶液倒吸的作用
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液中先产生白色沉淀,然后沉淀又溶解
D. 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
【答案】B
【解析】
A.若A为浓盐酸,B为KMnO4晶体,二者反应生成氯气,把氯气通到紫色石蕊溶液中,氯气与水反应生成HCl和HClO,HCl使紫色石蕊溶液变红,HClO具有漂白性,使溶液褪色,C中溶液最终呈无色,A错误;
B.D中球形干燥管中间部分较粗,盛放液体的量较多,倒吸的液体靠自身重量回落,因此可以防止液体倒吸,B正确;
C.若A为浓氨水,B为生石灰,滴入后反应生成氨气,氨气和铝离子反应生成氢氧化铝,但氢氧化铝不溶于弱碱一水合氨,所以C中产生白色沉淀不溶解,C错误;
D.若A为浓硫酸,B为Cu,反应需要加热才能发生,如果不加热,则没有二氧化硫产生,所以C中溶液无变化,D错误;
故合理选项是B。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】常温下,向Ba(OH)2和NaOH混合溶液中缓慢通入CO2至过量(溶液温度变化忽略不计),生成沉淀物质的量与通入CO2体积的关系如下图所示。下列说法不正确的是
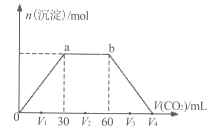
A. b点时溶质为NaHCO3
B. 横坐标轴上V4的值为90
C. V1、V2、V3时,溶液中c(Ba2+)·c(CO32-)相等
D. 原混合物中n[Ba(OH)2]:n(NaOH)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①盐酸溶液 ②石墨 ③蔗糖 ④CO2⑤熔融NaHSO4⑥Ba(OH)2固体 ⑦氨水 ⑧纯硫酸 ⑨NaCl固体
(1)属于电解质的有__________;属于非电解质的有________;能导电的物质有________。
(2)②和SiO2在高温下可发生如下反应:3C+SiO2![]() SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______;氧化剂与还原剂物质的量之比为_______。
SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______;氧化剂与还原剂物质的量之比为_______。
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-===H2O,该离子反应对应的化学方程式为________________________
(4)⑤的电离方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2-苯基丙烯 ,下列说法错误的是
,下列说法错误的是
A. 分子式为C9H10
B. 一定条件下,可以发生取代、加成和氧化反应
C. 1 mol该化合物最多可与4mol氢气发生加成反应
D. 分子中最多有8个碳原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和Cl2在一定条件下反应生成PCl5。
(1)有88 g CO2与足量H2恰好完全反应,生成气态水和甲醇,可放出1.2014×105 J的热量,试写出该反应的热化学方程式_______________________________________。
(2)25 ℃、101 kPa下,CH4的燃烧热为a kJ/mol,9 g液态水变为水蒸气吸热b kJ,则CH4燃烧生成二氧化碳和水蒸气热化学方程式为________________________________。
(3)硅与氯两元素的单质反应生成1mol硅的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________________________________________。
(4)CO2与CH4经催化重整制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)已知上述反应中相关的化学键键能数据如下:
2CO (g)+ 2H2(g)已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=________________________________。
(5)利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
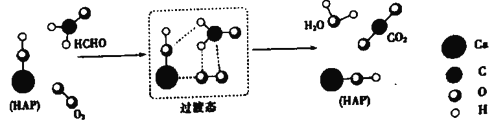
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用CO2是环境科学研究的热点课题,是减轻温室效应危害的重要途径。
(1)工业上,利用天然气与二氧化碳反应制备合成气(CO和H2),化学方程式为CO2(g)+CH4(g)=2CO(g)+2H2O(g)上述反应的能量变化如图1所示,该反应是________(填“吸热反应,或“放热反应”)。

(2)工业上用CO2生产甲醇(CH3OH)燃料,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molO2和4molH2,一定条件下发-反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,用CH3OH表示的平均反应速率为______。
②若反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.v(H2)=0.01molL-1s-1 B.v(CO2)=0.15molL-1s-1
C.v(CH3OH)=0.3molL-1min-1 D.v(H2O)=0.45molL-1min-1
该反应进行由快到慢的顺序为______(填字母)。
③下列描述能说明反应达到最大限度的是_______(填字母)。
A.混合气体的密度保持不变
B.混合气体中CH3OH的体积分数约为21.4%
C.混合气体的总质量保持不变
D.H2、CH3OH的生成速率之比为3:1
(3)甲醇(CH3OH)是一种可再生能源,具有广阔的开发和应用前景。以甲醇、氧气和KOH溶液为原料,石墨为电极制造新型手机电池,甲醇在______极反应,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com