
分析 (1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,据此排序;
(2)依据m=CVM计算需要溶质的质量;
(3)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液,不能用来测量容量瓶规格以下的任意体积的液体,是用来配制一定体积、一定物质的量浓度溶液的专用仪器等;
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,所以正确的顺序为:ABDCE;
故答案为:ABDCE;
(2)配制500mL 0.2mol/L的Na2SO4溶液,需要溶质的质量m=0.5L×0.2mol/L×142g/mol=14.2g;
故答案为:14.2;
(3)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,用到的仪器:托盘天平、钥匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少的仪器:500mL容量瓶、胶头滴管、药匙;
故答案为:500mL容量瓶、胶头滴管、药匙;
(4))①在配制溶液过程中,若缺少操作D,导致部分溶质损耗,溶质的物质的量偏小,将使配制的溶液浓度偏低;
故答案为:偏低;
②操作C中加蒸馏水时,不慎超过了刻度线,导致溶液体积偏大,将使配制的溶液浓度偏低;
故答案为:偏低;
(5)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选:BCE;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶的使用方法和注意问题,注意误差分析的方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:实验题
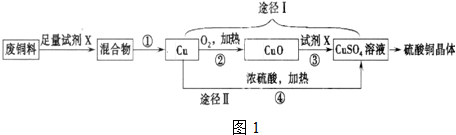

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )
在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )| A. | 正反应放热,L是气体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L不是气体 | D. | 正反应吸热,L不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )
如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )| A. | D中可以盛放浓硫酸 | B. | D中可以盛放饱和食盐水 | ||
| C. | D中可以盛放水 | D. | A处通入的是干燥的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等 | |
| B. | 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
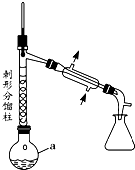 乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下: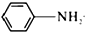 +CH3COOH$\stackrel{△}{?}$
+CH3COOH$\stackrel{△}{?}$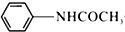 +H2O
+H2O| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com