
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8g H218O含有的中子数为NA
B. 0.1mol·L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1NA
C. 0.1mol 的CH4和NH3混合气体,含有的共价键数目为0.4NA
D. 4.6g Na与含0.1mol HCl的稀盐酸充分反应,转移电子数目为0.2NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物VL (标准状况),溶于mg水中,得到质量分数为w、 物质的量浓度为c mol/L、密度为g/mL的溶液,下列说法正确的是( )
A.相对分子质量 M=22.4mω/(1-ω)V
B.物质的量浓度c=ρv/(MV+22.4m)
C.溶液的质量分数ω=MV/22.4m
D.溶液密度ρ=cω/1000ρω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
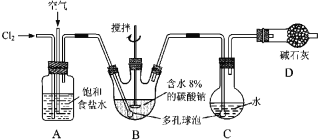
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是________________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是____________________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用_____取20.00 mL次氯酸溶液,加入足量的_________________,再加入足量的_______________,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度为1moI/L的是
A. 将6.2gNa2O溶解于水,并配成200mL溶液
B. 1L含1mol K+的K2SO4溶液
C. 将22.4LHC1溶于1L水
D. 将40.0 g NaOH溶于1L水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色![]() 已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀
已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀![]() ,则下列叙述正确的是( )
,则下列叙述正确的是( )
A.原溶液中的Br-一定被氧化
B.通入氯气之后原溶液中的Fe2+一定被氧化
C.溶液中一定不存在Fe2+
D.若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol,若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为______ 个。
(2)该气体若溶于1L水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为______ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

已知:
①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3b(NH4)2SO4cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是 (填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是 。
(3)写出反应②的化学方程式 。
(4)用滴定法测定制得的Ce(OH)4产品纯度。称取Ce(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4溶液滴定,所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL K2SO4和Al2(SO4)3的混合溶液,已知其中含Al3+1.08 g,SO42-6.72 g,则该溶液中K+的浓度为
A.0.1 mol/LB.0.15 mol/L
C.0.2 mol/LD.0.25 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com