
| 物质 | A | B | C |
| 初始浓度/mol?L-1 | 1.0 | 2.0 | 0 |
| 2min时,平衡浓度/mol?L-1 | 0.4 | 0.2 | 1.2 |
| 消耗量 |
| 起始量 |
| △c |
| △t |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.6mol/l |
| 1.0mol/L |
| 0.6mol/L |
| 2min |
| 1.22 |
| 0.4×0.23 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | 基态原子核外有三个能级,P级能电子处在半充满状态 |
| X | 常见的金属,在周期表中的中期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 存在总质量数为56,中子数为30的核数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑥ | B、②④⑤⑥ |
| C、②④⑥ | D、①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/0C | 250 | 310 | 350 |
| K/(mol/L)2 | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min | C(CO) | C(H2) | C(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
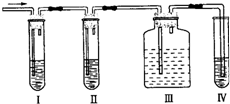 某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:
某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:5 |
| C、3:5 | D、5:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com