
分析 电离度=$\frac{已电离的一水合氨浓度}{一水合氨总浓度}$×100%,根据Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:已知在某温度下,1mol•L-1的氨水中c(OH-)=0.004mol•L-1,NH3•H2O?NH4++OH-,
电离度=$\frac{已电离的一水合氨浓度}{一水合氨总浓度}$×100%=$\frac{0.004mol/L}{1mol/L}$×100%=0.4%,
平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.004mol/L×0.004mol/L}{1mol/L-0.004mol/L}$=1.4×10-5,
答:此时NH3•H2O的电离度为0.4%,电离平衡常数为1.4×10-5.
点评 本题考查了弱电解质的电离、电离平衡常数的计算,弱电解质电离程度与溶液浓度的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | a=4 | |
| B. | S2O32-是氧化剂 | |
| C. | Y的化学式为Fe3O4 | |
| D. | 当有1 molO2参加反应时,转移电子的物质的量为4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果△H偏小 | |
| B. | 检验溶液中是否有SO42-时,应先将溶液用稀硝酸酸化 | |
| C. | 滴定管在装标准溶液前,必须先用待装标准溶液润洗 | |
| D. | NaHCO3溶液和稀盐酸可以用互滴的方法鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+HNO3(浓)--Zn(NO3)2+NO2↑+H2O | B. | Zn+HNO3(浓)--Zn(NO3)2+NO↑+H2O | ||
| C. | Zn+HNO3(很稀)--Zn(NO3)2+NO2↑+H2O | D. | Zn+HNO3(很稀)--Zn(NO3)2+NH4NO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
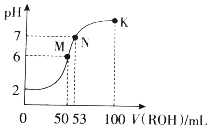 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )| A. | ROH为一元弱碱 | |
| B. | M点溶液呈酸性的原因是R++H2O?ROH+H+ | |
| C. | M、N、K三点水的电离程度逐渐减小 | |
| D. | K点溶液中离子浓度c(Cl-)>c(R+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com