
(16分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。
则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) H= kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) 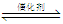 CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的H 0,(填“>”或“<”)。
若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”)。
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32 -)= 。[已知:Ksp(CaCO3)=2.8×10-9]
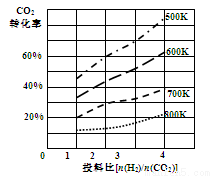
(4)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y 电极附近观察到的现象 ;当燃料电池消耗2.8 L O2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2—和Z-,Y+ 和Z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B.原子序数: X>Y>Z
C.单质沸点: X>Y>Z D.离子半径: X2—>Y+>Z—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安地区八校高三下学期联考三理综化学试卷(解析版) 题型:填空题
【化学选修3-物质结构与性质】(15分)X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2 -最外层电子数之和,根据以上信息回答下列问题:
(1)上述五种元素中电负性最大的是____(填元素符号,下同),Y的第一电离能大于Z的第一电离能原因 。
(2)XW2的电子式为 。Y3的分子构型为 。
(3)Q的价电子排布式为 。
(4)下列关于WZ2结构的说法正确的是 。
a.WZ2直线形非极性分子
c.WZ2中w为sp3杂化
b.WZ2直线形极性分子
d.WZ2中W为sp2杂化
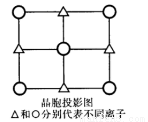
(5)d-QW的晶胞是立方体,用X射线衍射法测得该晶体晶胞边长a=520.0pm,26℃测得该晶体的密度为4.1g/cm3,请列式计算一个晶胞中含有的Q、W离子数。(5.23=140.6)
(6)d-QW的晶胞的一个侧面的投影图如图所示,与Q离子距离最近且距离相等的W离子构成的几何图形是________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省肥城市高三二模理综化学试卷(解析版) 题型:推断题
(17分)A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:

(1)若A为非金属单质,C、D的相对分子质量相差16。0.05 mol·L—1 E溶液中只有3种离子,且在25℃时,溶液中的c(H+)/c(OH—)=1012。
①写出E→C的一个化学方程式___________________________;
②在A→C的反应中,每转移1 mol e— 就会放热 143.5 kJ,该反应的热化学方程式为_________。
(2)若A为金属单质,B、C均属于盐类,D是一种白色沉淀。
①若B水溶液呈酸性,C水溶液呈碱性,则B溶液呈酸性的原因是______________(用离子方程式表示);
②若B溶液呈黄色,与硫氰化钾溶液混合后显红色,E是一种不溶性碱。B→C的离子方程式为___________。D→E的化学方程式为______________________。选用氢碘酸与可E反应实现E→C的转化,该反应的离子方程式为________________。
(3)若A~E均为含有Y元素的化合物,A是淡黄色固体,等物质的量浓度B、C两溶液,其中C溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C是工业侯氏制碱中的主要过程。则等浓度、等体积混合的C、E两溶液中所有离子浓度的大小关系为________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省肥城市高三二模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.232Th 转换成233U是化学变化,233U和235U的化学性质几乎相同
B.防止自行车钢架生锈主要是利用了电化学防腐原理
C.血液透析是利用了胶体的聚沉性质
D.葡萄酒中含有的微量的二氧化硫具有抗氧化剂作用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省张掖市高三4月诊断考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA
B.用惰性电极电解CuSO4溶液后,如果加入0.1 mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA
C.142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D.已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(9分)(1)某温度下,纯水中的c(H+)=3×10-7 mol/L,滴入稀H2SO4使c(H+)=5×10-6 mol/L,则c(OH-)=__ ,由水电离出的c(H+)为_____ 。
(2)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液;
②0.01 mol·L-1 HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(a)其中水的电离程度相同的是 ______;(填序号)
(b)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②、③混合(填“>”、“<”或“=”);
(c)将前四份溶液同等稀释10倍后,溶液的pH: ③________④ (填“>”、“<”或“=”);
(3)现有十种物质:①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体
⑥液氯 ⑦CuSO4固体 ⑧酒精 ⑨氯水 ⑩H2SO4
a.上述物质中可导电的是 (填序号,以下同);
b.上述物质中属于非电解质的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二下学期期中考试化学试卷(解析版) 题型:选择题
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;
⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;
A.③④⑤⑥ B.①③④⑤ C.①②③⑥⑦ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省德阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
有①CH3COOH、②HCl、③H2SO4三种溶液,下列说法不正确的是
A.pH相同时,其物质的量浓度由大到小的顺序是①>②>③
B.物质的量浓度相同时,其pH由大到小的顺序是①>②>③
C.中和等量的烧碱溶液,需等物质的量浓度的①②③三种酸溶液的体积比为2∶2∶1
D.体积和物质的量浓度均相同的①②③三溶液 ,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为2∶1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com