
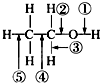
 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )| A. | 和金属钠反应时①键断裂 | |
| B. | 和乙酸发生酯化反应时②键断裂 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
分析 A.乙醇和钠反应生成氢气,氢氧键断裂;
B.和乙酸反应生成乙酸乙酯,O-H键断裂;
C.乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;
D.在空气中完全燃烧时生成二氧化碳和水.
解答 解:A.乙醇和钠反应生成氢气,断开的羟基上的氢氧键,即①键,故A正确;
B.和乙酸反应生成乙酸乙酯,O-H键断裂,即①断裂,故B错误;
C.乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢,即①③断裂,故C错误;
D.在空气中完全燃烧时生成二氧化碳和水,则断裂①②③④⑤,故D正确;
故选BC.
点评 本题考查有机物的结构与性质,侧重乙醇性质的考查,注意乙醇的性质与官能团、化学键的关系,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CHCl3>H2O>己烷 | |
| C. | 氢元素质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 等质量物质完全燃烧耗O2量:苯>环已烷>已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| 元素 | O | S | Se | Te |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com