
| A. | 加入少量的NaOH固体,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在着:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中离子浓度关系为:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在着:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
分析 A.向溶液中加入少量NaOH固体,抑制Na2S的水解;
B.根据质子守恒分析;
C.Na2S溶液存在S2-+H2O?HS-+OH-;
D.从物料守恒的角度分析.
解答 解:A.向溶液中加入少量NaOH固体,增大了钠离子浓度,c(OH-)增大,抑制Na2S的水解,Na2S溶液中的c(Na+)、c(S2-)均增大,故A正确;
B.Na2S溶液中存在着质子守恒,则:c(OH-)=c(H+)+c(HS-)+2c(H2S),故B错误;
C.Na2S溶液存在S2-+H2O?HS-+OH-,则有c(OH-)>c(H+),所以c(Na+)>c(S2-)>c(OH-)>c(H+),故C错误;
D.物料守恒可知Na的物质的量是S的物质的量的2倍,S在溶液存在形式有3种,所以$\frac{1}{2}$c(Na+)=c(S2-)+c(HS-)+c(H2S),故D错误.
故选A.
点评 本题考查离子浓度大小的比较,题目难度不大,注意从物料守恒的角度和质子守恒的角度分析,把握盐类水解的原理,易错点为D,注意离子浓度的关系.


科目:高中化学 来源: 题型:选择题
| A. | H2CO3、H2SiO3、HClO都属于弱酸 | B. | Na2O、MgO、Al2O3都属于碱性氧化物 | ||
| C. | 石英、纯碱、明矾都属于盐 | D. | 碱石灰、铁红、水泥都属于混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含硫原子数目之比是 5:4 | B. | 氧原子的物质的量之比为 3:2 | ||
| C. | 氧元素的质量之比为 6:5 | D. | 硫元素的质量之比为 4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
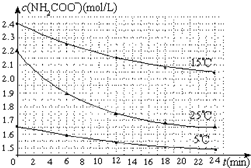 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.| 氟 | 氯 | 溴 | 碘 | |
(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫的排放会导致光化学烟雾的产生 | |
| C. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| D. | 硫粉在过量的纯氧中燃烧也不能生成三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
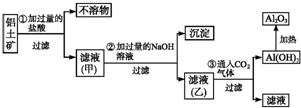 工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
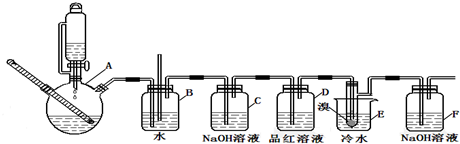
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm2 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ① | C. | ④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com