
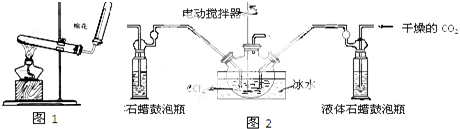
分析 (1)在加热条件下,实验室用氯化铵和氢氧化钙制取氨气;
(2)①该反应的正反应是放热反应,降低温度促进平衡正向移动;
②通过观察气泡判断加入物质的量多少;
③生成的氨基甲酸铵的小晶体悬浮在CCl4中,所以可以采用过滤方法分离提纯;基甲酸铵(NH2COONH4)是一种易水解、易分解的白色固体,加热温度要低于其熔点;
(3)氨气有刺激性气味,污染空气;
(4)沉淀的质量是碳酸钡的质量,则n(BaCO3)=$\frac{1.5760g}{197g/mol}$=0.008mol,根据C原子守恒得n(NH4HCO3)=n(BaCO3)=0.008mol,m(NH4HCO3)=0.008mol×79g/mol=0.632g,样品中氨基甲酸铵质量=
5.000g-0.632g=4.368g,从而计算其质量分数.
解答 解:(1)在加热条件下,实验室用氯化铵和氢氧化钙制取氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)①该反应的正反应是放热反应,降低温度促进平衡正向移动,从而提高反应物的转化率,且温度过高也导致产物分解,
故答案为:降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);
②通过观察气泡判断加入物质的量多少,从而控制反应速率,
故答案为:通过观察气泡,调节NH3与CO2通入比例 (或通过观察气泡,控制NH3与CO2的反应速率);
③生成的氨基甲酸铵的小晶体悬浮在CCl4中,所以可以采用过滤方法分离提纯;基甲酸铵(NH2COONH4)是一种易水解、易分解的白色固体,加热温度要低于其熔点,
故答案为:过滤;c;
(3)氨气有刺激性气味,污染空气,所以需要尾气处理装置,故答案为:在图2的出气导管末加一个尾气处理装置;
(4)沉淀的质量是碳酸钡的质量,则n(BaCO3)=$\frac{1.5760g}{197g/mol}$=0.008mol,根据C原子守恒得n(NH4HCO3)=n(BaCO3)=0.008mol,m(NH4HCO3)=0.008mol×79g/mol=0.632g,样品中氨基甲酸铵质量=
5.000g-0.632g=4.368g,其质量分数=$\frac{4.368g}{5.000g}×100%$=87.36%,
故答案为:87.36%.
点评 本题考查制备实验方案设计,为高频考点,涉及气体制备、实验操作、方程式的计算等知识点,侧重考查学生实验操作、对实验原理的理解、基本计算等能力,正确获取信息并运用信息解答问题是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 研发光电转换材料,充分利用太阳能 | |
| B. | 包装材料聚氯乙烯属于烃,会造成环境污染 | |
| C. | 用石灰对煤燃烧形成的烟气脱硫,并回收石膏 | |
| D. | 研发高效生物生长调节剂,减少对化肥的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 序号 | 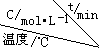 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
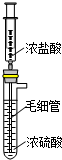 实验室用如图装置制备HCl气体.
实验室用如图装置制备HCl气体.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
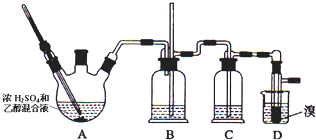
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
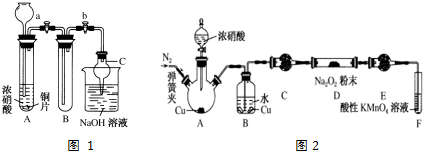
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
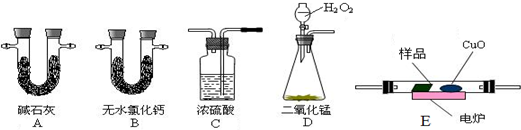
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com