
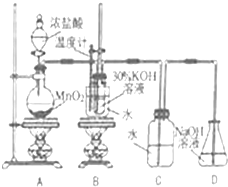
 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.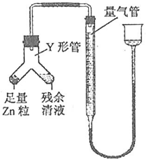 .
.分析 实验Ⅰ(1)A装置为实验室制取氯气装置,利用浓盐酸和二氧化锰反应,为控制反应速率,通常使用分液漏斗盛放浓盐酸;
(2)装置A的圆底烧瓶内浓盐酸和二氧化锰在加热条件下反应生成氯气、二氯化锰和水,根据质量守恒和电子守恒可写出此反应的化学方程式;
(3)A中生成的氯气在装置B中与KOH浓溶液在加热条件下反应生成氯酸钾、氯化钾和水,根据电子守恒、电荷守恒和原子守恒可写出此反应的离子方程式;
(4)若对调B和C装置的位置,C中盐酸抑制氯气的溶解,B中氯气与KOH加热生成氯酸钾;
实验Ⅱ中甲方案是利用酸碱中和原理测定装置A中剩余盐酸的物质的量浓度,而乙方案是根据剩余盐酸与Zn作用生成的氢气的体积,结合物质的量在化学方程式计算中的应用,计算盐酸的浓度,其实验的关键是要准确氢气的体积,并控制温度与室温相同;
①根据酸碱中和原理,n(NaOH)=n(HCl),利用消耗的标准NaOH溶液计算盐酸的浓度;
②(i)如果使右侧的残余清液转移到左侧与足量锌粉反应,则右侧会有附着液不能完全转移到左侧,会造成测量结果偏低;
(ii)读取氢气体积时要调整U形装置液面,保证气体的压强与外界压强相等,另外确保视线与凹液面最低处相切.
解答 解:实验Ⅰ(1)盛放浓盐酸的装置为分液漏斗,故答案为:分液漏斗;
(2)装置A中浓盐酸和二氧化锰在加热条件反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)装置B中与KOH浓溶液在加热条件下发生反应的离子方程式为3Cl2+6OH-$\frac{\underline{\;加热\;}}{\;}$ClO3-+5Cl-+3H2O,故答案为:3Cl2+6OH-$\frac{\underline{\;加热\;}}{\;}$ClO3-+5Cl-+3H2O;
(4)若对调B和C装置的位置,混合气体的HCl会被吸收,避免HCl与KOH的中和反应,能提高氯酸钾的产率,故答案为:能;水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率;
实验Ⅱ中甲方案是利用酸碱中和原理测定装置A中剩余盐酸的物质的量浓度,而乙方案是根据剩余盐酸与Zn作用生成的氢气的体积,结合物质的量在化学方程式计算中的应用,计算盐酸的浓度,其实验的关键是要准确氢气的体积,并控制温度与室温相同;
①量取试样20.00ml,用0.10mol•L-1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00ml,根据n(NaOH)=n(HCl)可知0.10mol•L-1×24.00ml×10-3L/mL=C(HCl)×20.00ml×10-3L/mL,解得C(HCl)=0.12mol•L-1,故答案为:0.12mol•L-1;
②(i)使左侧的锌粉转移到右侧残余清液反应,避免残余清液中的盐酸与锌粉完全反应,造成测量结果偏低,故答案为:锌粒;残余清液;
(ii)读取氢气体积时首先需冷却至室温,然后要调整调整量气管与漏斗内液面相平,并确保视线与凹液面最低处相切,故答案为:调整量气管与漏斗内液面相平.
点评 本题考查性质实验和含量测定实验,为高频考点,把握实验原理、实验技能及离子检验等为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1 mol 氨气充分溶解在1L水中 | |
| B. | 将10克质量分数98%的硫酸与990克水混合 | |
| C. | 将25克胆矾溶于水配成1L 溶液 | |
| D. | 将10 mL1mol/L的盐酸与90 mL水充分混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅用新制氢氧化铜悬浊液(可以加热)不能通过化学方法完成对葡萄糖溶液、乙醇和乙酸溶液的鉴别 | |
| B. | 利用加碳酸钠饱和溶液和分液的方法可以除去乙酸乙酯中的乙酸和乙醇 | |
| C. | CH3CH2CH2OH和CH3CH2CH2Cl的同分异构体数目相同 | |
| D. | 石油的分馏、裂化,煤的干馏,都是通过化学变化获得新物质的工业生产方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
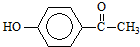 .这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
.这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )| A. | 能跟氢氧化钠反应 | |
| B. | 能跟浓溴水反应 | |
| C. | 能跟碳酸氢钠反应 | |
| D. | 在催化剂存在时能被还原成含醇羟基的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为2Cl--2e-═Cl2↑ | |
| B. | 钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-═Fe2+ | |
| C. | 精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-═Cu | |
| D. | 酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-═4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com