
 氧化锌、硫化锌都是重要的基础化工原料.
氧化锌、硫化锌都是重要的基础化工原料.分析 (1)ZnO和Al2O3的化学性质相似,氧化铝与氢氧化钠反应生成偏铝酸钠,据此模仿写出氧化锌与氢氧化钠的反应;
(2)①反应Ⅰ:ZnO(s)+CO(g)?Zn(g)+CO2(g),锌蒸气冷凝为冷凝物;
②结合平衡三行计算列式计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
③有利于提高反应Ⅰ中ZnO转化率,平衡正向进行;
④反应Ⅱ中,每转移1mol 电子,反应放热174kJ,结合反应定量关系和电子转移总数计算,转移4mol电子放热696KJ;
(3)①滴定管未用 EDTA 标准液润洗,内层水膜会稀释标准溶液,消耗标准溶液体积会增大;
②称取0.5000g样品,酸溶后定容于250mL容量瓶中,摇匀.量取25.00mL该溶液,用0.04000mol•L-1的EDTA(Na2H2Y)标准液滴定其中的Zn2+(反应方程式为 Zn2++H2Y2-═ZnY2-+2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准液15.12mL.
Zn2++H2Y2-═ZnY2-+2H+,
1 1
n 15.12×10-3L×0.04000mol/L
n(ZnO)=n(Zn2+)=15.12×10-3L×0.04000mol/L,
250mL溶液中n(ZnO)=15.12×10-3L×0.04000mol/L×$\frac{250}{25}$,
据此计算质量分数;
(4)将含有0.05mol ZnS的荧光粉溶于500mL盐酸中,完全溶解后溶液中锌离子浓度c(Zn2+)=$\frac{0.05mol}{0.5L}$=0.1mol/L.
解答 解:(1)ZnO和Al2O3的化学性质相似,氧化铝与氢氧化钠反应生成偏铝酸钠,所以氧化锌与氢氧化钠的反应的方程式为:ZnO+H2O+2OH-=[Zn(OH)4]2-,
故答案为:ZnO+H2O+2OH-=[Zn(OH)4]2-;
(2)①反应Ⅰ:ZnO(s)+CO(g)?Zn(g)+CO2(g),锌蒸气冷凝为冷凝物,冷凝物为金属锌,
故答案为:Zn;
②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3mol•L-1,反应过程中达到平衡 CO2 的体积分数 φ(CO2)如图所示为0.4,
ZnO(s)+CO(g)?Zn(g)+CO2(g)
起始量(mol/L) 0.3 0 0
变化量(mol/L) x x x
平衡量(mol/L) 0.3-x x x
$\frac{x}{0.3+x}$=0.4
x=0.2
平衡常数K=$\frac{0.2×0.2}{0.3-0.2}$=0.4,
故答案为:0.4;
③a.增大ZnO的投料量,氧化锌为固体不影响平衡,氧化锌转化率不变,故a错误;
b.反应前后气体体积不变,适当加压,不影响平衡移动,故b错误;
c.将锌蒸气及时分离,平衡正向进行氧化锌转化率增大,故c正确;
故答案为:c;
④反应Ⅱ中2Zn(g)+O2(g)═2ZnO(s),反应中2molZn完全反应电子转移4mol,反应每转移1mol 电子,反应放热174kJ,转移4mol电子反应放热696KJ,反应焓变△H=-696KJ/mol,
故答案为:-696KJ/mol;
(3)①滴定管未用 EDTA 标准液润洗,内层水膜会稀释标准溶液,消耗标准溶液体积会增大,测定结果偏高,故答案为:偏高;
②称取0.5000g样品,酸溶后定容于250mL容量瓶中,摇匀.量取25.00mL该溶液,用0.04000mol•L-1的EDTA(Na2H2Y)标准液滴定其中的Zn2+(反应方程式为 Zn2++H2Y2-═ZnY2-+2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准液15.12mL.
Zn2++H2Y2-═ZnY2-+2H+,
1 1
n 15.12×10-3L×0.04000mol/L
n(ZnO)=n(Zn2+)=15.12×10-3L×0.04000mol/L,
250mL溶液中n(ZnO)=15.12×10-3L×0.04000mol/L×$\frac{250}{25}$,
样品纯度=$\frac{15.12×1{0}^{-3}×0.04000×\frac{250}{25}×81}{0.5000}$×100%,
故答案为:$\frac{15.12×1{0}^{-3}×0.04000×\frac{250}{25}×81}{0.5000}$×100%;
(4)将含有0.05mol ZnS的荧光粉溶于500mL盐酸中,完全溶解后溶液中锌离子浓度c(Zn2+)=$\frac{0.05mol}{0.5L}$=0.1mol/L,Ksp(ZnS)=2.5×10-23=c(Zn2+)c(S2-),
c(S2-)≤2.5×10-22mol/L,
故答案为:2.5×10-22.
点评 本题考查了物质组成的探究、化学反应速率、化学平衡常数的计算、影响化学平衡因素分析、滴定实验的过程分析和计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
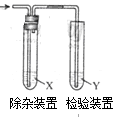 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )| 乙烯 的制备 | 试剂X | 剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
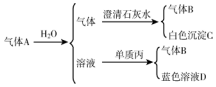
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸可用铁铝容器存放是因为常温下浓硫酸不与这两种金属反应 | |
| C. | 浓硫酸有强氧化性,稀硫酸不具有氧化性 | |
| D. | 实验室中利用浓硫酸的高沸点性来制备HCl等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,空间构型三角锥形
,空间构型三角锥形查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸有强氧化性而稀硫酸无氧无性 | |
| B. | 98%的硫酸(密度1.84g/cm3)与18.4mol/L的硫酸的浓度不同 | |
| C. | 浓硫酸可以使胆矾晶体变白 | |
| D. | 浓硫酸与铜反应中,被氧化和被还原的物质的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 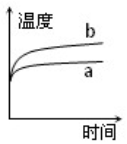 | B. | 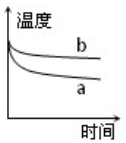 | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com