
| 1×0.4mol |
| 2 |
| 0.4mol×3 |
| 2 |
| ||
| 5min |
| 0.2mol |
| 1mol |
| 4mol-0.6mol |
| 4.6mol |


科目:高中化学 来源: 题型:
| A、滤液中c(Fe3+)=4.0×10-29mol?L-1 |
| B、沉淀为Fe(OH)3和Fe(OH)2的混合物 |
| C、向滤液中加入少量FeCl2溶液,一定有沉淀生成 |
| D、向滤液中继续加入NaOH溶液使pH>7时,有Fe(OH)2沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海南岛四面环海,水资源丰富,不必节约用水 |
| B、明矾既能沉降水中的悬浮物,又能杀菌消毒 |
| C、可通过长期饮用含Ca2+浓度较高的水来补钙 |
| D、若不慎接触敌敌畏或甲胺磷,最好用碱性肥皂液清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验需用到的主要玻璃仪器包括大、小烧杯,温度计,环形玻璃搅拌棒及泡沫塑料板、碎泡沫塑料(或硬纸板、碎纸条)等 |
| B、盐酸与某强碱中和放出的热量随反应物用量的改变而改变,但中和热不变 |
| C、NaOH稍过量的目的是保证盐酸完全被NaOH中和 |
| D、测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000 mL,212 g |
| B、950 mL,201.4 g |
| C、500 mL,286 g |
| D、任意规格,572 g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
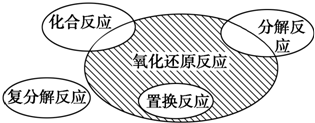
A、Fe2O3+3CO
| ||||
B、2KClO3
| ||||
C、Na2O2+2Na
| ||||
| D、Cl2+2KBr═Br2+2KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com