
0.1 mol/L K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.1 mol/L。如果要使c(CO32-)更接近于0.1 mol/L,可以以采取的措施是
A.加入少量盐酸 B.加入水
C.加热 D.加入适量KOH固体
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门市高二下学期质量检测化学试题 题型:填空题
(6分)下列反应在210℃时达 到平衡:
到平衡:
①PCl5(g)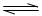 PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
②CO(g)+C12(g)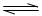 COCl2(g) △H2<O K2=5×104 mol·L-1
COCl2(g) △H2<O K2=5×104 mol·L-1
③COCl2(g)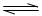 CO(g)+Cl2(g) K3=?
CO(g)+Cl2(g) K3=?
④2SO2(g)+O2(g)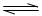 2SO3(g) △H4<0
2SO3(g) △H4<0
(1)反应③的平衡常数K3为  。
。
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号,下同)。
A.降低反应①、②体系中Cl2浓度
B.反应①降低温度,反应②维持210℃
C.反应①、反应②同时升高温度
(3)欲使反应④向正方向移动,可采取的措施是
A.恒温下扩大容器体积 B.减少SO3的物质的量
C.恒压下升温
查看答案和解析>>
科目:高中化学 来源:2015届广东省高二上学期期中考试化学试卷(解析版) 题型:填空题
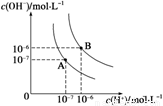
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
|
化学式 |
电离平衡常数(25 ℃) |
|
HCN |
K=4.9×10-10 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:2013届海南省高二1班下学期期末考试化学试卷(解析版) 题型:填空题
(12分)常温下,ZnS的溶度积常数Ksp=1.20×10-23 ,H2S的电离常数K1=1.32×10-7 K2=7.10×10-15 回答下列问题:
(1)K1>>K2的原因是
(2)0.1 mol/L H2S溶液中氢离子的物质的量浓度是 (填字母)
A、等于0.1mol/L B、等于0.2mol/L
C、小于0.1mol/L D、在0.1~0.2mol/L之间
(3)0.1mol/LNa2S 溶液能使pH试纸变蓝,表明该现象的离子方程式是
(4)已知0.1mol/LNaHS溶液的pH约为9,则0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是 。该溶液中的质子守恒关系式为
。
(5)向0.01mol/L的ZnCl2溶液中通入H2S(g)至饱和(c(H2S)按0.1mol/L计),为保证不产生ZnS沉淀,应控制c(H+)不低于 mol/L(已知7.811/2 =2.8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com