
A.防止硫酸铁分解 B.抑制硫酸铁水解
C.提高硫酸铁的溶解度 D.提高溶液的pH
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:阅读理解
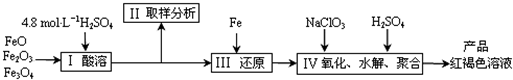
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医疗上使用的“钡餐”中所含的硫酸钡是强电解质 | B、明矾在水中能够形成Al(OH)3胶体,故其可用作净水剂 | C、实验室常将氯化铁先溶于盐酸,再加水稀释来配制其溶液 | D、在元素周期表的IIIA、IVA和VA族可以找到优良的光电材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市密云二中高二(下)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com