
����Ŀ����ͼ��ʾϸ����ijЩ�л����Ԫ����ɺ��ܹ�ϵ������A��B����Ԫ�أ������������ӣ�ͼ��X��Y��Z��P�ֱ�Ϊ�����������ӵĻ�����λ����ش��������⣺

��1��ͼ��X��________������С����������Ҫ��ָ__________��
��2���ڲ����У�Я���Ŵ���Ϣ��������________________������ţ���
��3��ͼ��A��B�ֱ��������Ԫ�أ�A��______��B��______��
��4�����µ�����������ֶ�����ֱ��ԭ����[ ] _________������ź����ƣ��ṹ�Ķ����ԡ�
��5�����ʢ�������ϸ���е���Ҫ������________���÷�����______________���������ʢ�Ķ����ԡ�
���𰸡������ǣ� ���� ���� N��P N [��]������ Ⱦɫ�壨�ʣ� �������������Ŀ������˳��
��������
�����ԡ�ϸ����ijЩ�л����Ԫ����ɺ��ܹ�ϵͼ��Ϊ���壬����ѧ����ϸ���ڵ��л�����ӵĻ�ѧ��ɼ����ܵ����֪ʶ��ʶ�Ǻ������������Լ���ȡ��Ϣ�����������������
(1) �����Ⲣ���ͼʾ������֪����Դ���ʢ��Ƕ��ǣ���ֲ��ϸ����С������ϸ��������Ҫ��ָ���ۡ���ɶ��ǵĻ�����λX�������ǡ�
(2) Я���Ŵ���Ϣ���Ǻ��ᣬ������Ҫ�ֲ���ϸ�����еĢ���DNA����Ҫ�ֲ���ϸ�����еĢ���RNA������ֻ����һ�ֺ��DNA��RNA������ڲ����У�Я���Ŵ���Ϣ�������Ǣ���
(3)��϶�(2)�ķ�����֪��Y�����DNA�Ļ�����λ���������ᣬZ�����RNA�Ļ�����λ���Ǻ�������Ǻ����������������ᶼ����C��H��O��N��P��ɣ����A��ʾN��P���е�������Ģ��ǵ����ʣ�P����ɵ����ʵĻ�����λ�����ᣬ������Ļ������Ԫ����C��H��O��N������B��ʾN��
(4)�����������������Ҫ�е��ߣ���˵��µ�����������ֶ�����ֱ��ԭ����[��]�����ʽṹ�Ķ����ԡ�
(5)���ʢ���DNA��DNA��Ҫ�ֲ���Ⱦɫ���ϣ��������ʢ�������ϸ���е���Ҫ������Ⱦɫ�塣DNA�Ļ�����λ���������ᣬ��ɢ���������������Ŀ������˳��ͬ�����������ʢ�Ķ����ԡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ![]() ���ܱ������ڣ�����
���ܱ������ڣ�����![]() ��
��![]() ��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��
��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��![]() �ı仯��ϵ��ͼ��������������ȷ���ǣ� ��
�ı仯��ϵ��ͼ��������������ȷ���ǣ� ��
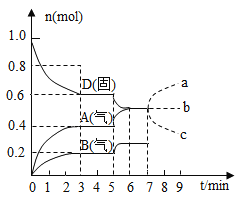
A. ���ڵ�7����ʱ����![]() �����ʵ��������ʾ
�����ʵ��������ʾ![]() �����ʵ����仯��ȷ����a����
�����ʵ����仯��ȷ����a����
B. �÷�Ӧ�Ļ�ѧ����ʽΪ![]() ���÷�Ӧ��ƽ�ⳣ������ʽΪ
���÷�Ӧ��ƽ�ⳣ������ʽΪ![]()
C. ��֪��Ӧ��![]() �����5����ʱͼ����������仯��ԭ�������������ϵ���¶�
�����5����ʱͼ����������仯��ԭ�������������ϵ���¶�
D. �ӷ�Ӧ��ʼ����һ�δﵽƽ��ʱ��![]() ���ʵ�ƽ����Ӧ����Ϊ
���ʵ�ƽ����Ӧ����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ʱHClO��Ka=3.0��10-8��HF��Ka=3.5��10-4���ֽ�pH���������ͬ�Ĵ�������������Һ�ֱ������ˮϡ�ͣ�pH����Һ����ı仯��ͼ��ʾ������������ȷ����
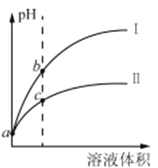
A. ����IΪ������ϡ��ʱpH�仯����
B. ȡa�����������Һ���к���ͬ�������ͬŨ�ȵ�NaOH��Һ�����Ĵ�����������С
C. a��ʱ������������ͬ��С��п������ʱ������ᷴӦ�����ʴ�
D. b����Һ��ˮ�ĵ���̶ȱ�c����Һ��ˮ�ĵ���̶�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ������ڵ�һ����
�� | ||||||||
�� | �� | �� | ||||||
�� | �� | �� | �� | |||||
(1)��-��Ԫ���н�������ǿ��Ԫ��λ�����ڱ��е�λ��Ϊ______________________��
(2)������γɵĻ���������ˮ����ҷ�Ӧ���ɰ�ɫ����������A,��д���÷�Ӧ�Ļ�ѧ����ʽ ___________________ ������A��ʵ�����Ʊ���ѧ����ʽΪ______________��
(3)�����γɵĵ�����ˮ��Ӧ�ķ���ʽ _____________���÷�Ӧ��������_______��Ӧ��
(4)�ڡ��ۡ��ߵ���ۺ����������������ǿ��˳����__________________���û�ѧʽ��ʾ������������ĸ�Ԫ���������������γɵ���̬�⻯���ȶ�����ǿ������˳���ǣ��û�ѧʽ��ʾ��__________________��
(5)����Ԫ�آۡ�����������������ˮ�������Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����淴ӦA(g)+3B(g) ![]() 2C(g)�ﵽƽ��ı�־��
2C(g)�ﵽƽ��ı�־��
A. C���ɵ�������C�ֽ���������
B. ��λʱ��������n molA��ͬʱ����3nmol B
C. A��B��C��Ũ�����
D. A��B��C�ķ�����֮��Ϊ1��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪N2H4(g)��O2(g)=N2(g)��2H2O(g) ��H����534 kJ��mol��1���������Ȼ�ѧ����ʽ����ȷ����
A. ![]() N2H4(g)��
N2H4(g)��![]() O2(g)=
O2(g)=![]() N2(g)��H2O(l) ��H����267 kJ��mol��1
N2(g)��H2O(l) ��H����267 kJ��mol��1
B. ![]() N2H4(g)��
N2H4(g)��![]() O2(g) =
O2(g) = ![]() N2(g)��H2O(g) ��H����267 kJ��mol��1
N2(g)��H2O(g) ��H����267 kJ��mol��1
C. 2N2H4(g)��2O2(g)=2N2(g)��4H2O(g) ��H����1068 kJ��mol��1
D. N2(g)��2H2O(l) = N2H4(g)��O2(g) ��H����534 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ���ǣ� ��
A. ��Fe�缫���NaCl��Һ��2Cl����2H2O![]() 2OH����H2����Cl2��
2OH����H2����Cl2��
B. ������������������Fe3O4+8H+ +2I-=3Fe2+ +4H20+I2
C. ̼��������Һ�м�����������ʯ��ˮ��Ca2++OH-+HCO3-=CaCO3��+H2O
D. ����������Һ������������Һ��������ԣ�2H++SO42-+Ba2++2OH-=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������н��з�Ӧ��3H2(g) + N2(g)![]() 2NH3(g)������һ��ʱ���NH3���ʵ�������0.8 mol�����ʱ������N2��ʾ��ƽ����Ӧ����Ϊ0.01 mol��L-1��s-1�������ʱ��Ϊ
2NH3(g)������һ��ʱ���NH3���ʵ�������0.8 mol�����ʱ������N2��ʾ��ƽ����Ӧ����Ϊ0.01 mol��L-1��s-1�������ʱ��Ϊ
A. 10 sB. 20 sC. 30 sD. 40 s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶��£������ᣨ�����ᣩ��ˮϡ�����У���Һ�ĵ���������ͼ��ʾ����
��1����㵼������Ϊ0��������__________________��
��2����ʪ���pH��ֽ����a����Һ��pH���������______��ƫ��ƫС�䣩
��3���Ƚ�a��b��c������������ݴ�С�������ϵ������a��b��c��c=a��b��a=b=c�ȣ�

��pH��________��
�ڴ���ĵ���̶ȣ�_________��
�۴���ĵ���ƽ�ⳣ����____________��
��a��b��c������Һ��1mol/L����������Һ�кͣ���������������Һ�����______��
��4����ʹc����Һ��c��CH3COO��������c��H+����С���ɲ��õĴ�ʩ�У�����ͬ�����ʣ�����_________,��__________.
��5����ϡ�����У�����c��CH3COOH���Ľ��ͣ�����ʼ�ձ����������Ƶ�����______��
A��c��H+�� B��H+���� C��CH3COOH���� D��![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com