
在FeCl3和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是( )
①只有Fe2+ ②Fe2+和Fe3+
③Fe2+和Cu2+ ④Cu2+和Fe3+
A.①③ B.②④
C.①④ D.②③
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )。
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1,实验测得有关数据如下:
| 容器编号 | 起始时各物质的物质的量 /mol | 达到平衡时体系能量的变化数值 /kJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | Q2 |
| 丙 | 0 | 0 | 2 | Q3 |
下列判断中正确的是( )
A.197>Q2>Q1
B.若升高温度,反应的热效应不变
C.Q3=197
D.生成1 mol SO3(l)时放出的热量大于98.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种“反应物”在40~50 ℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。下列有关推断中错误的是 ( )。
A.这里的“另一种反应物”具有还原性
B.CuH可作氧化剂、还原剂
C.CuH+Cl2===CuCl+HCl(燃烧)
D.CuH+HCl===CuCl+H2↑(常温)
查看答案和解析>>
科目:高中化学 来源: 题型:
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下:
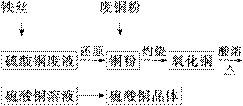 |
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有_____________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是______________
________________________________________________________________________。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
过去电子工业常用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为:
2FeCl3+Cu===2FeCl2+CuCl2。
(1)检验腐蚀后的溶液中是否含有Fe3+应选用的试剂是____________。
(2)采用下列实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液,请在各空格内填上适当的分子式或化学式以使实验达到预期目的。
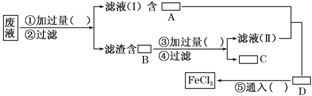
(3)写出有关化学反应的离子方程式_______________________________________,
__________________________________________________,
__________________________________________________,
__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在常压和500 ℃条件下,等物质的量的Ag2O、Fe(OH)3、NH4HCO3、NaHCO3,完全分解,所得气体体积依次为V1、V2、V3、V4。体积大小顺序正确的是( )
A.V3>V2>V4>V1 B.V3>V4>V2>V1
C.V3>V2>V1>V4 D.V2>V3>V1>V4
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
________________________________________________________________________。
(2)同浓度的CH3COO-、HCO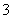 、CO
、CO 、ClO-结合H+的能力由强到弱的顺序为________________________________________________________________________。
、ClO-结合H+的能力由强到弱的顺序为________________________________________________________________________。
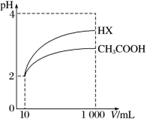
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了钠与氯气反应的装置,如下图所示。将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,直到钠熔融成圆球时,停止加热,通入氯气,即可见钠燃烧起来,产生大量白烟。下面的有关叙述错误的是( )
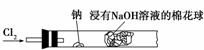
A.钠燃烧产生苍白色火焰
B.浸有NaOH溶液的棉花球是用于吸收过量的氯气,以避免污染空气
C.反应产生的大量白烟是氯化钠晶体
D.若在棉花球外沿滴一滴淀粉碘化钾溶液,可以判断氯气是否被碱液完全吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com