云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注.利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理.
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr
2O
2-7,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程.

(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是:
.
(2)在含Cr
2O
2-7废水中存在着平衡:
Cr2+H20?
2Cr+H+,请写出该平衡的平衡常数表达式k=
,若继续加水稀释,平衡将
移动(填“正向”、“逆向”“不”).
(3)请写出通入SO
2时发生的离子反应方程式:
.
(4)写出加入铝粒在高温下发生反应制取铬的化学方程式
.
Ⅱ.还有一种净化处理方法是将含+6价Cr的废水放人电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe
2+和Cr
2O
2-7发生反应,生成的Fe
3+和Cr
3+在阴极区与OH
-结合生成Fe(OH)
3和Cr(OH)
3沉淀除去[已知K
SPFe(OH)
3=4.0×10
-38,K
SPCr(OH)
3=6.0×10
-31].
①电解过程中NaCI的作用是
.
②已知电解后的溶液中c(Fe
3+)为2.0×10
-13mol?L
-1,则溶液中c(Cr
3+)为
mol?L
-1.




 它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )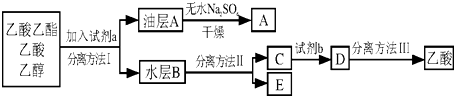

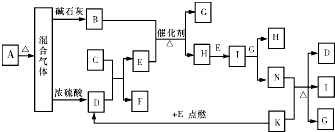 如图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物.固态物质A(混合物)加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D.各物质间的转化关系如图所示.请回答下列问题:
如图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物.固态物质A(混合物)加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D.各物质间的转化关系如图所示.请回答下列问题: