
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2LSO3所含的氧原子数为1.5NA
B.电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA
C.常温常压下,7.8gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
D.在含Al3+总数为NA的AlCl3溶液中,Cl总数为3NA
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:2017届河北省高三上周考(9.4)化学试卷(解析版) 题型:选择题
“加碘食盐”“含氟牙膏”“高钙牛奶”等商品中的碘、钙、氟是指( )
A.离子 B.分子 C.单质 D.元素
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述不相符合的是

A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源:2017届河北省沧州市高三上周测化学试卷(解析版) 题型:选择题
SF6是一种优良的绝缘气体,分子结构中存在S—F键。已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF—F、S—F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A.-1780kJ/mol B.-1220kJ/mol
C.-450kJ/mol D.+430kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届河北省沧州市高三上周测化学试卷(解析版) 题型:选择题
下列根据实验现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 废FeCl3蚀刻液中加入少量铁粉,振荡 | 得到澄清溶液 | 蚀刻液中一定不含Cu2+ |
B | 将Fe(NO3)2样品溶于H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
C | KBrO3溶液中加入少量苯,然后通入少量Cl2,充分振荡,静置 | 下层有机相呈橙红色 | 氧化性:Cl2>Br2 |
D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省沧州市高三上周测化学试卷(解析版) 题型:选择题
为了探索月球上是否有生命存在的痕迹,就要分析月球岩石中是否包含有碳氢化合物(当然这仅仅是探索的第一步)。科学家用氘盐酸(DCl)和重水(D2O)溶液处理月球岩石样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物。这个实验不能用普通盐酸,其理由是
A. 普通盐酸酸性太强
B. 普通盐酸有强挥发性
C. 普通盐酸与月球岩石中的碳化物无法反应
D. 无法区别月球岩石中原来含有的是碳化物,还是碳氢化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二下期末化学试卷(解析版) 题型:实验题
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1)从上述步骤中可知,海带中含有的碘元素的主要存在形式是 (填化学式)。
(2)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A烧杯 B表面皿 C坩埚 D酒精灯 E干燥器
(3)步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指列实验装置中的错误之处。

① ;② ;③ ;
进行上述蒸馏操作时,使用水浴的原因是 ;最后晶态碘在 里聚集。
(4)步骤④反应的离子方程式是 。若用碘盐中的KIO3作氧化剂,在酸性溶液中氧化I—,写出反应的离子方程式 。
(5)检验海带中是否含有碘元素,可以在步骤④后进行,检验时可用的试剂是 。
(6)步骤⑤中,某学生选择用苯来提取碘,其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50毫升碘水和15毫升苯加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)将分液漏斗上口倒出上层溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层。
就此实验,完成下列填空:
正确操作步骤的顺序是 → → →A→G→ →E→F
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学测化学试卷(解析版) 题型:选择题
分子式为C4H8Cl2的有机物共有(不含立体异构)
A. 7种 B.8种 C.9种  D.10种
D.10种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师大附中高二上第一次月考化学卷(解析版) 题型:填空题
已知体积为2L的恒容密闭容器中发生反应:2SO2(g) + O2(g) 2SO3(g),请根据化学反应的有关原理同答下列问题
2SO3(g),请根据化学反应的有关原理同答下列问题
(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速 率为_____________________。
率为_____________________。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)___________。
①混合气体的密度不变 ②混合气体的平均相对分子质量不变
③ v正(SO2)=2v正(O2) ④各气体的浓度都不再发生变化
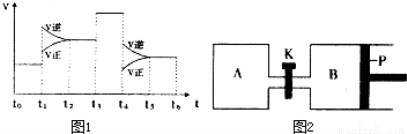
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3 的百分含量最高的是( )
A、t2→t3 B、t0→t1 C、t5→t6 D、t3→t4
据图分析:你认为t3时改变的外界条件可能是__________;
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体 积
积 为1.2a L,容器B中SO3转化率为___________。
为1.2a L,容器B中SO3转化率为___________。
②若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com