
| A. | NO3- | B. | Ba2+ | C. | OH- | D. | Cu2+ |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制500mL该溶液,可将0.1 mol BaCl2溶于500mL水中 | |
| B. | Ba2+和Cl-的物质的量浓度都是0.1 mol•L-1 | |
| C. | 将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.2 mol•L-1 | |
| D. | 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
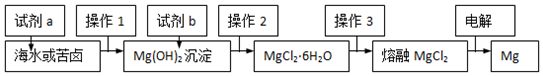
| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯,后点燃 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| C. | 2,2-二甲基丙烷与Br2在光照下反应,其一溴取代物只有一种 | |
| D. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
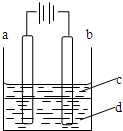 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀.若用如图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀.已知两极材料分别为石墨和铁:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀.若用如图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀.已知两极材料分别为石墨和铁:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com