
为检验某卤代烃中的卤元素,进行如下操作,正确的顺序是
①加热②加入 溶液③取少量该卤代烃④加入足量稀硝酸酸化
溶液③取少量该卤代烃④加入足量稀硝酸酸化
⑤加入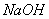 溶液⑥冷却
溶液⑥冷却
A. ③①⑤⑥②④ B. ③⑤①⑥④② C. ③②①⑥④⑤ D. ③⑤①⑥②④
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是 ( )
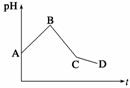
A.阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2
B.AB段阳极只产生Cl2,阴极只产生Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段相当于电解水
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯(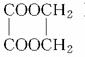 )的正确顺序是
)的正确顺序是
( )
A.①⑤②③④ B.①②③④⑤
C.②③⑤①④ D.②③⑤①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应所得溶液中一定只含一种溶质的是
A.向AlCl3溶液中滴入NaOH溶液 B.向NaOH溶液中通入SO2气体
C.向稀硝酸中加入过量铁粉 D.向Na2CO3溶液中滴入盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式_______________ 。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF63Si+2K AlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
AlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
A.Al是还原剂 B .氧化产物只有KAlF4
.氧化产物只有KAlF4
C.每转移6NA电子,得到42 g Si D.Al元素在KAlF4和K2AlF5中化合价不同
②用白砂子与镁粉混合在高温条件下得到无定形硅,反应的化学方程式为___________ 。
(3)在野外,为了迅速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO。这种混合物叫做生氢剂。请写出该反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )。
A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小
D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液和溴水。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①__________,②__________,③__________,④__________
⑤_____ _____。
_____。
(2)图中现象a、b、c表明检验出的离子分别是:
a__________、b__________、c__________。
(3)白色沉淀A加试剂②反应的离子方程式是____________________________
__________________。
(4)无色溶液C加试剂③的主要目的是_________________________________
______________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是___________________________________________
 ________。
________。
(6)气体E通入试剂④发生反应的离子方程式是__________________________
____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在化学反应中,随着物质的变化,化学能也发生改变,还可能伴随着不同形式的能量转化。已知:破坏1 mol氢气中的化学键需要吸收436 kJ能量;破坏1/2 mol氧气中的化学键需要吸收 249 kJ的能量;形成水分子中1 mol H—O键能够释放 463 kJ能量。下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在相应的横线上。
①________kJ ②________kJ ③________kJ
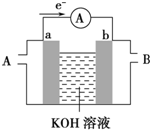 (2)某种电池的工作原理示意如图所示,
(2)某种电池的工作原理示意如图所示,
①若两电极是Mg、Al,则 a 是 ;(填“Mg”或“Al”)为原电池的 极(填“正”或“负”),该电极反应方程式为
②若此电池为氢氧燃料电池,b电极中通入的是
气体,发生 反应(填“氧化”或“还原”),该电极反应方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com