
【题目】有一白色粉末X,对X检验时,所做实验和现象为:
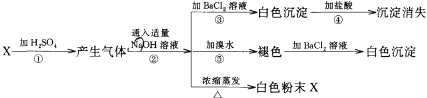
(1)写出X的化学式___。
(2)在①步反应中H2SO4的作用是___。
①在水溶液中电离,并呈强酸性 ②具有高沸点、难挥发性 ③浓硫酸具有吸水性 ④浓硫酸具有脱水性 ⑤浓硫酸具有强氧化性
(3)写出④、⑤两步反应的离子方程式:___、___。
【答案】Na2SO3 ①② BaSO3+2H+=Ba2++SO2↑+H2O SO32-+Br2+H2O=2H++SO42-+2Br-
【解析】
根据加氯化钡溶液产生白色沉淀,加入盐酸沉淀会消失和加入溴水,溴水褪色,说明具有还原性离子,且反应后加入氯化钡也会产生白色沉淀,所以X为亚硫酸钠,与硫酸反应生成二氧化硫,二氧化硫与氢氧化钠反应得到亚硫酸钠,则X为Na2SO3,据此分析。
根据加氯化钡溶液产生白色沉淀,加入盐酸沉淀会消失和加入溴水,溴水褪色,说明具有还原性离子,且反应后加入氯化钡也会产生白色沉淀,所以X为亚硫酸钠,与硫酸反应生成二氧化硫,二氧化硫与氢氧化钠反应得到亚硫酸钠,则X为Na2SO3;
(1) X的化学式为Na2SO3;
(2) 在①步反应中硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水,则H2SO4的作用是①在水溶液中电离,并呈强酸性、②具有高沸点、难挥发性;
答案为①②;
(3)二氧化硫与氢氧化钠反应的离子方程式为: SO2+2OH=SO32-+ H2O;亚硫酸钠与氯化钡反应生成与硫酸钡沉淀,离子方程式为:Ba2++SO32-=BaSO3↓;亚硫酸钠与溴水发生氧化还原反应生成硫酸钠和氢溴酸,离子方程式为:SO32-+Br2+H2O=2H++SO42-+2Br-。


科目:高中化学 来源: 题型:
【题目】25℃时,某混合溶液中![]() ,1gc( CH3COOH)、1gc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是
,1gc( CH3COOH)、1gc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是
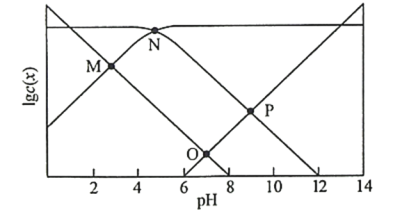
A.O点时,![]()
B.N点时,![]()
C.该体系中,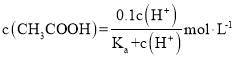
D.pH由7到14的变化过程中, CH3COO-的水解程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
A.  在NaCl晶体中,距Na+最近的Cl-形成正八面体
在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 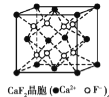 在CaF2晶体中,每个晶胞平均占有4个Ca2+
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 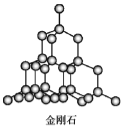 在金刚石晶体中,碳原子与碳碳键数目比为1∶2
在金刚石晶体中,碳原子与碳碳键数目比为1∶2
D. 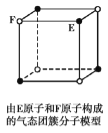 由E原子和F原子构成的气态团簇分子的分子式为EF或FE
由E原子和F原子构成的气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
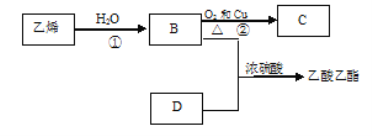
(1)乙烯的结构简式为:______________
(2)写出化合物官能团的化学式及名称:
①B中含官能团_________名称________;
②D中含官能团__________名称_________;
(3)写出反应的化学方程式
①__________反应类型:___________
②__________反应类型:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu在加热条件下能与浓硫酸反应(反应Ⅰ),但工业上制取CuSO4却不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断由容器的下部吹入细小的空气泡(反应Ⅱ)。
(1)写出反应Ⅰ、Ⅱ的化学方程式___、___。
(2)试分析反应Ⅱ的制备办法的优点___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气(Cl2)是高中化学一种非常重要的气体单质,它是制备许多化工产品的原料。
Ⅰ.甲同学在实验室用体积比为1:3的氯气和空气(不参与反应)的混合气体与潮湿的碳酸钠反应来制备Cl2O,其实验装置如图所示。
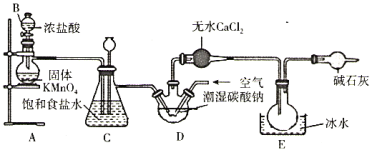
已知:Cl2O熔点为-120.6℃,沸点为2.0℃,常温常压下为一种棕黄色气体。
(1)仪器B的名称为________,KMnO4与浓盐酸反应生成Cl2的离子方程式为________。
(2)装置C的作用为________,装置E中的现象是________。
(3)氯气与潮湿的碳酸钠制Cl2O的化学方程式为________。
Ⅱ.乙同学在实验室用Cl2和熔融的S反应制备S2Cl2,其实验装置如图所示。

已知:S2Cl2熔点为-76℃,沸点为138℃,常温下为橙黄色的液体,遇水易水解。
(4)W中盛放的试剂为________。
(5)乙同学应进行合理的操作顺序为________(填序号)。
a.点燃酒精灯 b.停止通氯气 c.开始通氯气 d.熄灭酒精灯
(6)检验S2Cl2和水反应的产生的气体为SO2的实验操作为________。
(7)本实验需改进的地方为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):下列判断正确的是( )
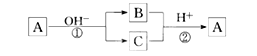
A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。(已知阿伏加德罗常数的值为NA)
(1)基态![]() 原子核外的最高能层符号是________,基态
原子核外的最高能层符号是________,基态![]() 最外层电子排布式为________。
最外层电子排布式为________。
(2)乳酸锌[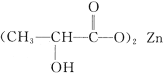 ]是一种很好的食品锌强化剂,其中存在的作用力有________(填编号)。
]是一种很好的食品锌强化剂,其中存在的作用力有________(填编号)。![]() 乳酸锌中含有________个σ键。
乳酸锌中含有________个σ键。
A.离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
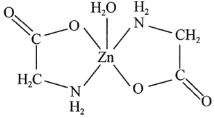
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是________,![]() 分子的空间构型为________形,
分子的空间构型为________形,![]() 的配位数为________。甘氨酸(
的配位数为________。甘氨酸(![]() )中N原子的杂化轨道类型为________;甘氨酸易溶于水,试从结构角度解释________。
)中N原子的杂化轨道类型为________;甘氨酸易溶于水,试从结构角度解释________。
(4)Zn与S形成某种化合物的晶胞如图所示。
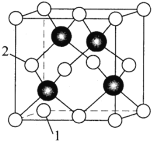
![]()
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为![]() ,则原子2的坐标为________。
,则原子2的坐标为________。
②已知晶体密度为![]() ,
,![]() 半径为
半径为![]() ,若要使
,若要使![]() 、
、![]() 相切,则
相切,则![]() 半径为________
半径为________![]() (写计算表达式)。
(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,请填写下列空白:
(1)移取10.00mL密度为ρg/mL的过氧化氢溶液至250mL容量瓶中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式,请将相关物质的化学计量数及化学式填写在方框里。__________
![]() MnO4-+
MnO4-+![]() H2O2+
H2O2+![]() H+=
H+=![]() Mn2++
Mn2++![]() H2O+
H2O+![]()
![]()
(3)滴定时,将高锰酸钾标准溶液注入_____(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是________。
(4)复滴定三次,平均耗用cmol/LKMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com