
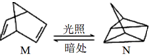
 △H=+88.6kJ/mol
△H=+88.6kJ/mol分析 (1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a>-238.6;
(3)有0.5mol Cl2参与反应时释放出70kJ热量,2mol氯气反应放热280kJ,注物质聚集状态和对应反应焓变写出热化学方程式;
(4)所给反应中转移12个电子,故每转移1mol电子放出的热量为$\frac{1200KJ}{12}$=100kJ.
解答 解:(1)有机物M经过太阳光光照可转化成N,:△H=+88.6kJ•mol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;
故答案为:M;
(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热,焓变为负值比较大小可知,a>-238.6KJ/mol,
故答案为:>;
(3)有0.5mol Cl2参与反应时释放出70kJ热量,2mol氯气反应放热280kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-280kJ•mol-1 ;
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-280kJ•mol-1 ;
(4)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1200kJ/mol,则反应过程中,碳化合价0价降低为-4价做氧化剂被还原生成TiC,还原产物是TiC,转移12mol电子放热1200KJ,则反应过程中,每转移1mol电子放热100kJ,
故答案为:TiC;100.
点评 本题考查了化学反应能量变化,燃烧热概念分析判断,氧化还原反应电子转移的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
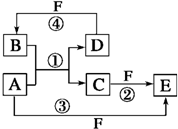 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).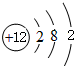 ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NCl3、CH4 | ||
| C. | BCl3、CH2═CH2、环己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Y2-的半径要小于R- | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式为: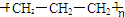 | B. | 丙烷分子的比例模型为: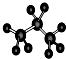 | ||
| C. | 羟基的电子式: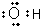 | D. | 2-乙基-1,3-丁二烯分子的键线式: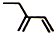 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
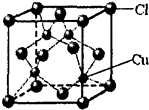 结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.
结构决定性质,性质体现结构.对结构和性质的研究是学好化学的基础.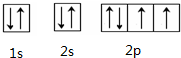
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇,乙醇 | B. | 乙醇,1-丙醇 | C. | 2-丙醇和1-丁醇 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com