
【题目】只改变一个影响因素,下列关于平衡常数K的叙述错误的是
A. K值不变,平衡可能移动B. K值变化,平衡一定移动
C. 温度变化,K值一定变化D. 平衡移动,K值一定变化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上利用铬铁矿(FeO![]() Cr2O3)冶炼铬的工艺流程如下:
Cr2O3)冶炼铬的工艺流程如下:

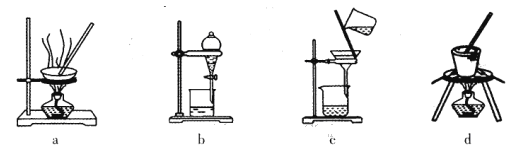
(1)实验室焙烧铬铁矿可选用的装置是__________(填序号)。
(2)完成下列化学方程式(在横线上填写物质的化学式及计量数):4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+_____________。
(3)操作I包括过滤与洗涤,过滤需要的玻璃仪器有:__________________________。
(4)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3溶于氢氧化钠溶液的
离子方程式_________________________________。
(5)由Cr2O3冶炼Cr的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
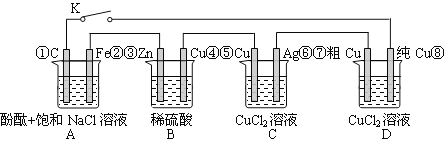
A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH < 0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH < 0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A. 正反应速率:v(a)>v(c) v(b)>v(d)
B. 平衡时a点一定有n(CO):n(H2)=1:2
C. 平衡常数:K(a)>K(c) K(b)=K(d)
D. 平均摩尔质量:![]() (a)<
(a)<![]() (c)
(c)![]() (b)>
(b)>![]() (d)
(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中除Na+外,还含有SO42—、HCO3—、SO32—和Br—等离子,通入足量Cl2,溶液中离子浓度增大的是
A. SO42— B. HCO3— C. SO32— D. Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中含有 SO2 等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
ⅠCaCO3(s)![]() CO2(g)+CaO (s) △H = + 178.2 kJ/mol
CO2(g)+CaO (s) △H = + 178.2 kJ/mol
ⅡSO2(g)+CaO(s)![]() CaSO3(s) △H = - 402 kJ/mol
CaSO3(s) △H = - 402 kJ/mol
Ⅲ 2CaSO3(s) + O2 (g) + 4H2O(l)![]() 2[CaSO4· 2H2O](s) △H = - 234.2 kJ/mol
2[CaSO4· 2H2O](s) △H = - 234.2 kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式________________________________________________________
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是_______________
a.3个容器中SO2的平衡转化率的大小顺序为:αA > αB > αC
b.当A容器内气体的平均摩尔质量不变时,说明该反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA > tB
d.当 C 容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据上述反应Ⅱ来除硫,将一定量的烟气压缩到一个 20 L的容器中,测得不同温度下,容器内 SO2 的质量(mg)如下表:
时间/min SO2质量/mg 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
T2 | 2100 | 869 | 242 | x | x | x | x |
①在T1温度下,计算20~40min内SO2 的反应速率____________mol/(L· min)。
②若其它条件都相同,则T1______T2(填“>”、 “<” 或 “=”,下同); x _____ 0.06。
③在T2温度下,若平衡后将容器的容积压缩为10 L,则新平衡时SO2的浓度_____原平衡时SO2的浓度(填“>”、 “<” 或 “=”),理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向弱酸HB溶液中加入强碱MOH溶液反应后,溶液的pH=7。下列判断正确的是
A. 加入的碱过量
B. 生成的盐不发生水解
C. 混合前酸与碱溶液中溶质的物质的量相等
D. 反应后溶液中B-、M+物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )
A. 9:1 B. 1:11 C. 1:9 D. 11:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com