
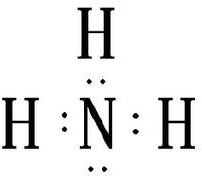 .
.分析 (1)依据6.4g的甲隔绝空气加热,充分反应后生成2.24L(标准状况下测定,下同)的氮气和3.6g的水,计算甲中含有氮原子、氢原子、原子物质的量;依据甲与足量的氢氧化钠浓溶液混合并加热,充分反应后能收集到2.24L气体乙,乙能使湿润的红色石蕊试纸变蓝,可知乙为氨气,甲为铵盐,6.4g甲中含有0.1mol氨根离子,据此推断甲的化学式;
(2)A.氨气与硝酸钠溶液不反应;
B.硝酸铁与氨气反应生成氢氧化铁沉淀;
C.硝酸铝与氨气反应生成氢氧化铝沉淀;
D.氨气与硝酸银反应,先生成氢氧化银,继续通氨气,反应生成银氨溶液;
(3)依据一氧化氮与氨气中氮元素化合价结合氧化还原反应规律解答.
解答 解:(1)由题意:6.4g的甲隔绝空气加热,充分反应后生成2.24L(标准状况下测定,下同)的氮气和3.6g的水,6.4g甲中含有0.2mol氮原子,0.4mol氢原子,0.2mol氧原子;取相同质量的甲与足量的氢氧化钠浓溶液混合并加热,充分反应后能收集到2.24L气体乙,乙能使湿润的红色石蕊试纸变蓝,可知该气体乙为氨气,
其物质的量为0.1mol,依据原子个数守恒可知,6.4g甲中含有0.1mol氨根离子,依据原子个数守恒,可知甲中阴离子中含有0.1mol氮原子,0.2mol氧原子,为NO2-,甲为NH4NO2;乙为氨气,含有3个N-H键,电子式为: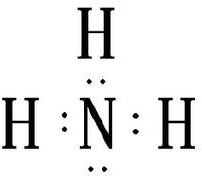 ;
;
故答案为:NH4NO2;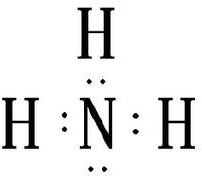 ;
;
(2)A.氨气与硝酸钠溶液不反应,不会产生沉淀,故A选;
B.硝酸铁与氨气反应生成氢氧化铁沉淀,故B不选;
C.硝酸铝与氨气反应生成氢氧化铝沉淀,故C不选;
D.氨气与硝酸银反应,先生成氢氧化银,继续通氨气,反应生成银氨溶液,最终不会产生沉淀,故D选;
故选:AD;
(3)NO中的氮的化合价为+2价,NH3中的氮的化合价为-3价,因而有可能发生氧化还原反应生成氮气;
故答案为:可能; NO中的氮的化合价为+2价,NH3中的氮的化合价为-3价,因而有可能发生氧化还原反应生成氮气.
点评 本题考查了铵盐、电子式的书写等,明确铵盐的性质及氧化还原反应规律是解题关键,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+结构示意图: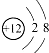 | B. | CCl4分子的比例模型: | ||
| C. | NH4Cl的电子式: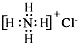 | D. | 2-甲基丁醇的结构简式: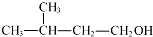 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
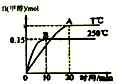
| A. | 混合气体的密度不变能说明该反应到达平衡状态 | |
| B. | a>0 | |
| C. | 其他条件不变,若减小容积体积,CO质量分数增大 | |
| D. | 平衡常数K:T℃时大于250℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | I元素的质量数是131 | B. | I元素的中子数是78 | ||
| C. | I原子5p亚层有一个未成对电子 | D. | I原子有53个能量不同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
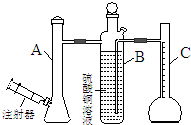
| A. | 反应前后抽气使B中导管内外液面持平 | |
| B. | 用饱和食盐水代替A装置中的蒸馏水 | |
| C. | 把A装置浸入盛有冰水混合物的水槽中 | |
| D. | 在B装置中的硫酸铜溶液表面覆盖一层苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 氨水吸收足量的SO2气体:NH3•H2O+SO2═NH4++HSO3- | |
| C. | 少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com