
分析 ①0.1mol•L-1 AgNO3溶液和0.1mol•L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c,白色沉淀c为AgCl,滤液b中主要含有硝酸钠;
②向滤液b中滴加0.1mol•L-1KI溶液,出现浑浊,说明生成AgI沉淀,说明滤液b中含有银离子;
③向沉淀c中滴加0.1mol•L-1KI溶液,沉淀变为黄色,说明AgCl可转化为AgI;
④向AgI中滴加0.1mol•L-lNaCl溶液,无明显现象,说明AgI不能转化为AgCl,以此解答该题.
解答 解:①0.1mol•L-1 AgNO3溶液和0.1mol•L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c,白色沉淀c为AgCl,滤液b中主要含有硝酸钠;
②向滤液b中滴加0.1mol•L-1KI溶液,出现浑浊,说明生成AgI沉淀,说明滤液b中含有银离子;
③向沉淀c中滴加0.1mol•L-1KI溶液,沉淀变为黄色,说明AgCl可转化为AgI;
④向AgI中滴加0.1mol•L-lNaCl溶液,无明显现象,说明AgI不能转化为AgCl,
(1)由以上分析可知沉淀c为AgCl,故答案为:AgCl;
(2)步骤②中的现象说明滤液b中含有的微粒是Ag+,故答案为:Ag+;
(3)步骤③中反应的离子方程式是AgCl(s)+I-=AgI(s)+Cl-,说明AgCl可转化为AgI,故答案为:AgCl(s)+I-=AgI(s)+Cl-;
(4)根据实验,可以得出的结论是难溶盐在水中存在溶解平衡;通过溶解平衡的移动,溶解度小的难溶盐转化为溶解度更小的难溶盐容易实现,
故答案为:难溶盐在水中存在溶解平衡;通过溶解平衡的移动,溶解度小的难溶盐转化为溶解度更小的难溶盐容易实现.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质、实验现象以及结论的总结,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
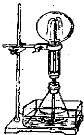 如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )
如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )| A. | 生石灰 | B. | 食盐 | C. | 蔗糖 | D. | 固体NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2.98 kJ•mol-1 | B. | -2.98 kJ•mol-1 | ||
| C. | +1807.98 kJ•mol-1 | D. | -1807.98 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:④>②>③>① | B. | 原子半径:④>③>②>① | ||
| C. | 电负性:④>③>①>② | D. | 最高正化合价:④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 氢氧化钠溶液 | C. | 氨水 | D. | 硝酸钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com