
| A. | 同周期元素含氧酸的酸性随核电荷数的增加而增强 | |
| B. | 核外电子排布相同的微粒,化学性质也相同 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{37}^{17}$Cl得电子能力相同 |
分析 A、同周期元素最高价含氧酸的酸性随核电荷数的增加而增强;
B、比如钾离子和氯离子,它们的电子排布是相同的,但两者的化学性质不同;
C、氢原子无中子;
D、同位素化学性质相似.
解答 解:A、同周期元素最高价含氧酸的酸性随核电荷数的增加而增强,而不是含氧酸,故A错误;
B、比如钾离子和氯离子,它们的电子排布是相同的,但两者的化学性质不同,故B错误;
C、氢原子无中子,所以并不是所有原子的原子核都由质子和中子构成,故C错误;
D、同位素化学性质相似,所以两者得电子能力相同,故D正确;
故选D.
点评 本题考查元素周期律、原子的构成微粒和同位素的化学性质,学生成要清楚非金属性越强最高价氧化物对应水化物的酸性越强,比较容易.


科目:高中化学 来源: 题型:选择题
| A. | 2 mol水的摩尔质量和1 mol水的摩尔质量 | |
| B. | 1 mol/L氯化钙溶液中n(Cl-)和2 mol/L氯化钾溶液中n(Cl-) | |
| C. | 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 | |
| D. | 20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
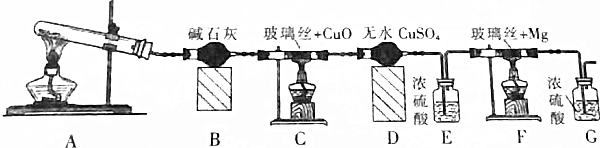
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代,4 mol Cl2 | B. | 加成、取代,3 mol Cl2 | ||
| C. | 加成,2 mol Cl2 | D. | 加成、取代,5 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| D. | 用液溴和苯在催化剂作用下制溴苯: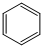 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(2n-4m)}{V}mol•{L}^{-1}$ | B. | $\frac{(n-m)}{V}mol•{L}^{-1}$ | C. | $\frac{(2n-2m)}{V}mol•{L}^{-1}$ | D. | $\frac{(5n-10m)}{V}mol•{L}^{-1}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com