
【题目】如图所示,在不同的电解质溶液中可以组成不同的电池.
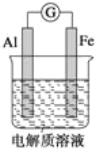
(1)当电解质溶液为稀硫酸时,Fe 电极是_____(填“正”或“负”)极,其电极反应式为______.
(2)当电解质溶液为 NaOH 溶液时,Al 电极是______(填“正”或“负”)极,其电极反应式为______.
(3)若把铝改为锌,电解质溶液为浓硝酸,则 Fe 电极的电极反应式为______.
【答案】正 2H++2e﹣═H2 ↑ 负 Al﹣3e﹣+4OH﹣═AlO2﹣+2H2 O NO3﹣+2H ++e﹣═NO2↑+H2O
【解析】
(1)①电解质溶液是稀硫酸时,Al电极是负极,Fe电极是正极;
②当电解质溶液是NaOH溶液时,铝与NaOH溶液反应,而Fe不反应,故铝作原电池的负极;
(2)把铝改为锌,用浓硝酸作电解质溶液,铁遇浓硝酸发生钝化,则Fe电极是正极,Zn电极是负极。
(1)①电解质溶液是稀硫酸时,Al电极是负极,Fe电极是正极,正极反应式为2H++2e﹣═H2 ↑;
②当电解质溶液是NaOH溶液时,铝与NaOH溶液反应,而Fe不反应,故铝作原电池的负极,电极反应式为Al﹣3e﹣+4OH﹣═AlO2﹣+2H2 O;
(2)把铝改为锌,用浓硝酸作电解质溶液,铁遇浓硝酸发生钝化,则Fe电极是正极;Zn电极是负极,Fe电极上的电极反应式为NO3﹣+2H ++e﹣═NO2↑+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①②B.③④C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中属于镁条在空气中燃烧产物的是( )
①MgCO3 ②Mg(OH)2 ③MgO④C ⑤Mg3N2 ⑥CO
A.①②③
B.⑤⑥
C.③④⑤
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
序号 | c(NO)/molL-1 | c(H2)/molL-1 | 速率/molL-1min-1 |
Ⅰ | 0.0060 | 0.0010 | 1.8×10-4 |
Ⅱ | 0.0060 | 0.0020 | 3.6×10-4 |
Ⅲ | 0.0010 | 0.0060 | 3.0×10-5 |
Ⅳ | 0.0020 | 0.0060 | 1.2×10-4 |
下列说法错误的是
A. 整个反应速度由第①步反应决定
B. 该反应速率表达式:v=5000c2(NO)·c(H2)
C. 正反应的活化能:①<②
D. 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g) △H=-664kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
选项 | 实验操作 | 实验目的 |
A | 加新制的Cu(OH)2并加热 | 确定尿液中含有葡萄糖 |
B | 滴加稀溴水 | 确定苯中混有甲苯 |
C | 加入金属钠 | 确定酒精中混有醋酸 |
D | 加淀粉 | 确定KCl中含有KI |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小的排列顺序正确的是( )
甲:500 ℃,10 mol SO2和5 mol O2反应
乙:500 ℃,V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:450 ℃,8 mol SO2和5 mol O2反应
丁:500 ℃,8 mol SO2和5 mol O2反应
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁
C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A. | 次氯酸有强氧化性 | 用作漂白剂 |
B. | 氢氧化铝能与酸反应 | 用作抗酸药 |
C. | 明矾易溶于水 | 可作净水剂 |
D. | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤块粉碎,经脱硫处理,在适当过量的空气中燃烧,这样处理的目的是( )
①使煤充分燃烧,提高煤的利用率;②减少二氧化硫的产生,避免造成“酸雨”;③减少有毒的一氧化碳产生,避免污染空气;④减少二氧化碳的产生,避免“温室效应”。
A.①②③
B.②③④
C.①③④
D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com