
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:① Cc(s)+ 1/2O2 (g)=CO (g) △H1=-l26.4kJ·mol-1
②③C(s)+O2 (g) =CO2 (g) △H2=-393.5kJ·mol-1
@S(s)+O2 (g)=SO2 (g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
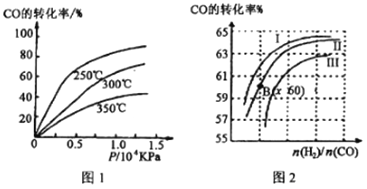
① CO转化率与温度、压强的关系如图所示,该反应△H_______0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为___________。测得B(x,60)点氢气的转化率为40%,则x=___________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=___________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
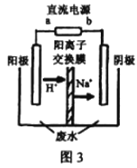
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:4OH- -4e-=O2↑+2H2O;__________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_______ kg(结果保留2位小数)。
【答案】 SO2(g) +2CO (g) =S(s)+2CO2 (g) △H=-237.4kJ ·mol-1 < K1>K2>K3 3 4.5L2·mol2 (不带单位不扣分) CH3CHO+H2O-2e-=CH3COOH+2H+ 0.19
【解析】(1)根据盖斯定律得,目标方程式=②×2-①×2-③,ΔH=(-393.5kJ/mol)×2-(-126.4kJ/mol)×2-(-296.8kJ/mol)=-237.4kJ/mol,所以所求热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) ΔH=-237.4kJ/mol;(2)①由图1可知,温度升高CO的转化率降低,说明升高温度,平衡逆向移动,正向是放热反应,ΔH<0;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大,所以K1、K2、K3的大小关系为K1>K2>K3测得B(X,60)点氢气的转化率为40%,CO的转化率是60%,设B点时CO、H2的物质的量分别是m、n,可得60%m=![]() ,所以
,所以![]() =3,即x=3;
=3,即x=3;
②设平衡时CO的浓度是x,则氢气的浓度是2x-1,生成甲醇的浓度是1-x,根据题意得: ![]() =2:1,x=
=2:1,x=![]() mol/L,所以K=
mol/L,所以K=![]() =4.5 L2·mol-2;(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气,则阴极发生还原反应,乙醛被还原为乙醇,同时氢离子被还原为氢气,所以阳极电极反应式除生成氧气外,还有CH3CHO-2e-+H2O═CH3COOH+2H+;②阴极反应是CH3CHO+2e-+2H+=CH3CH2OH,所以注入1m3乙醛的含量为300mg/L的废水,阴极区乙醛的去除率可达60%,生成乙醇的质量是1000L×300mg/L×60%×10-3g/mg÷44g/mol×46g/mol=188.2g=0.19kg。
=4.5 L2·mol-2;(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气,则阴极发生还原反应,乙醛被还原为乙醇,同时氢离子被还原为氢气,所以阳极电极反应式除生成氧气外,还有CH3CHO-2e-+H2O═CH3COOH+2H+;②阴极反应是CH3CHO+2e-+2H+=CH3CH2OH,所以注入1m3乙醛的含量为300mg/L的废水,阴极区乙醛的去除率可达60%,生成乙醇的质量是1000L×300mg/L×60%×10-3g/mg÷44g/mol×46g/mol=188.2g=0.19kg。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 足量乙酸与碳酸钠溶液反应: 2 CH3COOH +CO32-→ 2CH3COO-+CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O
C. 苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D. 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃基异构化是当前环保的急切要求,正戊烷异构化为异戊烷的热化学方程式是: CH3CH2CH2CH2CH3![]() CH3CH(CH3)CH2CH3 △H=-7.1 kJ·mol-1
CH3CH(CH3)CH2CH3 △H=-7.1 kJ·mol-1
(1)正戊烷异构化反应选择的温度条件是____________。
(2)由于副反应较为复杂,提髙产率的最佳方法是____________。
(3)如果提高温度,反应速率___________,转化率___________(填“升高"“不变”或“降低” ),同时还会产生积炭现象,假如在反应物中掺入一定量水,则可以减弱这种现象,理由是___________(用化学方程式表示)。
(4)在573 K时,正戊烧转化率为54%,则此时平衡常数为___________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,将生成物先后通过浓硫酸和碱石灰,两者分别增重0.144 g和0.528 g,生成物完全被吸收。试回答以下问题:
(1)维生素C中碳的质量分数是_____________,氢的质量分数____________
(2)维生素中是否含有氧元素?为什么?(试通过计算说明)
(3)如果需要你确定维生素C的分子式,你还需要哪些信息?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学利用以下装置制取并探究氨气的性质:

(1)装置A中发生反应的化学方程式为 ___________。
(2)装置B中的干燥剂是_______(填名称)。
(3)装置C中的现象是 _______。
(4)实验进行一段时间后,挤压装置D中的胶头满管,滴入1-2滴浓硫酸,可观察到的现象是_______。
(5)为防止过量氨气外逸,需要在上述装置的末端增加—个尾气吸收装置,应选用的装置是_______(填 “E"成“F"),尾气吸收过程中发生反应的化学方程式为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
A. 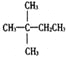 B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如下图, 发生器内电解生成ClO2。下列说法正确的是
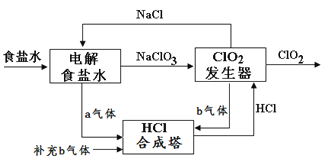
A. a气体是氯气,b气体是氢气
B. 氯化钠电解槽内每生成2 mol a气体,转移2mol e-
C. ClO2发生器中阴极的电极反应式为:2ClO3- + 12H+ + 10e-![]() Cl2↑ + 6H2O
Cl2↑ + 6H2O
D. 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置 如右下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1︰2,以下说法不正确的是

A. a极与电源的正极相连
B. 产物丙为硫酸溶液
C. 离子交换膜d为阳离子交换膜(允许阳离子通过)
D. a电极反应式为2H2O+2e-=2OH-+ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com