
| A. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | 室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 | |
| D. | 室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
分析 A.由阳离子、阴离子离子构成的化合物化合物是离子化合物,一般由活泼金属和活泼非金属元素组成;
B.pH相差2,氯离子浓度相差100倍,PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的100倍;
C.根据Kw计算溶液中氢离子与氢氧根离子的浓度;
D.将pH=5的H2SO4溶液稀释1000倍,c(H+)接近1×10-7mol/L,c(SO42-)变为原来的$\frac{1}{1000}$.
解答 解:A.氯化氢是两种非金属元素构成的化合物,属于共价化合物,NaCl属于离子化合物,故A错误;
B.PH=4.5的番茄汁中c(H+)=10-4.5mol/L,PH=6.5的牛奶中c(H+)=10-6.5mol/L,则pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故B错误;
C.室温下,pH=3的亚硫酸溶液中的氢离子浓度为10-3mol/L,pH=11的氨水中的氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,则室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等,故C正确;
D.将pH=5的H2SO4溶液稀释1000倍,c(H+)接近1×10-7mol/L,c(SO42-)变为原来的$\frac{1}{1000}$,以稀释后溶液中SO42-离子浓度与H+离子浓度的比值约为:5×10-9mol/L:1×10-7mol/L=1:20,故D错误;
故选C.
点评 本题考查了离子化合物的概念、水的电离、溶液pH的简单计算,题目难度中等,注意明确氢离子与溶液的pH的转化关系是解题的关键,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 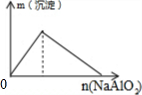 向盐酸中滴入NaAlO2溶液 | B. | 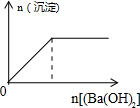 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | ||
| C. | 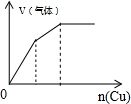 将铜粉加入到一定浓硝酸中 | D. | 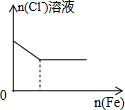 将铁粉加入到一定量氯化铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 0.1 | 0.2 | 0 |
| 平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
| A. | 前3 min内,用Y的变化量表示的平均反应速率v(Y)=0.05mol•L-1•min-1 | |
| B. | 反应达到平衡时,X的转化率为50% | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 反应可表示为X+3Y?2Z,其平衡常数为1600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中铁元素的化合价降低 | B. | 该反应属于分解反应 | ||
| C. | 该反应不属于置换反应 | D. | 该反应属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同位素 | |
| B. | 氯气能使潮湿的蓝布条变为白色,说明氯气有漂白性 | |
| C. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L | |
| D. | 焰色反应发生的是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnCl2溶液 | B. | NaCl溶液 | C. | CaCl2溶液 | D. | FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com