
【题目】水是生命之源,与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)H2O水分子的VSEPR模型为_______形,氧原子的杂化方式为_____
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+),用电子式表示它的形成过程为___________________________,
(3)对于(2)中涉及的变化过程的描述不合理的是________。
a.氧原子的杂化类型发生了改变 b.微粒的形状发生了改变
c.微粒的化学性质发生了改变 d.微粒中的键角发生了改变
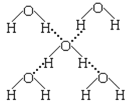
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol(设气态水中无氢键)。
【答案】四面体 sp3 ![]() a 20
a 20
【解析】
计算O原子价层电子对数,确定水分子VSEPR模型及杂化类型;根据形成配位键,用电子式写出形成过程;根据水中氧的杂化为sp3,H3O+中氧的杂化为sp3,据此判断不合理选项;利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能。
(1)H2O中价层电子对个数=2+![]() =4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3;答案为四面体,sp3。
=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3;答案为四面体,sp3。
(2)H2O中O原子存在孤对电子,H+有空轨道,以配位键的形式结合成水合氢离子(H3O+),用电子式表示它的形成过程为![]() ;答案为
;答案为![]() 。
。
(3)a.水分子中O原子价层电子对个数=2+![]() =4,所以采用sp3杂化,H3O+中氧原子价层电子对个数=3+
=4,所以采用sp3杂化,H3O+中氧原子价层电子对个数=3+![]() =4,所以采用sp3杂化,则氧原子的杂化类型没有改变,故a错误;
=4,所以采用sp3杂化,则氧原子的杂化类型没有改变,故a错误;
b.水分子中O原子采用sp3杂化,且O原子含有2个孤电子对,所以其空间构型为V形结构;H3O+中O原子采用sp3杂化,且O原子含有1个孤电子对,所以其空间构型为三角锥型,则微粒的形状发生了改变,故b正确;
c.H2O为中性分子,H3O+为酸性的阳离子,微粒的化学性质发生了改变,故c正确;
d.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故d正确;
答案为a。
(4) 冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),根据图象知,每个水分子与相邻的4个水分子形成氢键,每根氢键属于2个水分子,则1mol水中含有2mol氢键,升华热=范德华力+氢键,所以氢键=升华热-范德华力,冰晶体中氢键的“键能”= ![]() =20kJ/mol;答案为20。
=20kJ/mol;答案为20。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度是1.25g·L-1,B、C、D、E均为常见的有机物, 在一定条件下,它们有如下图所示的转化关系。

请回答:
(1) A分子中官能团的名称是_______,能与金属钠反应放出氢气的物质有______ (填字母)。
(2)反应⑤的化学方程式是____________________ ( 有机物用结构简式表示)。
(3)下列说法不正确的是___________
A.实验室制备D时将生成的D冷凝到装有水的试管里,以除去D中少量的杂质
B.反应④属于取代反应
C.相同物质的量的A、B或C充分燃烧时消耗等量的氧气
D.葡萄糖在一定条件下分解可以生成有机物B
查看答案和解析>>
科目:高中化学 来源: 题型:
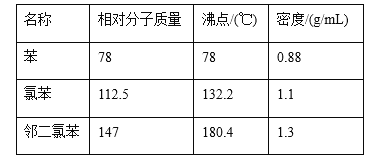
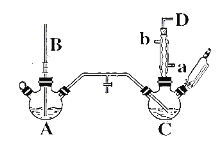
【题目】氯苯的合成工艺分为液相法和气相法两种,实验室模拟液相法的装置如下图(其中夹持仪器、加热装置及尾气处理装置已略去),有关物质的性质如表所示
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中中空导管B的作用是_______________。
(2)把干燥的氯气通入装有50.0mL干燥苯、少量铁屑的三颈烧瓶C中制备氯苯,写出本方法制备氯苯的化学方程式_____________。
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②_______,D出口的主要尾气成分有___________________。
(4)提纯粗产品过程如下:
![]()
净化过程中加入无水CaCl2的目的是_____________。
(5)实验中最终得到产品22.5mL,产率为______________。
(6)气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯。其反应方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下图所示:

已知:Ⅰ. RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
Ⅱ.![]()
请回答下列问题:
(1)A的分子式是___________;
(2)E的结构简式是________________,反应⑥的反应类型是____________ 。
(3)等物质的量的G分别与足量Na、NaHCO3溶液反应,生成的气体在相同状况下体积比为______。
(4)J中官能团的名称为__________
(5)写出反应⑤的化学方程式:____________。
(6)写出一种符合下列条件的PMAA单体的同分异构体的结构简式:_______。
a.具有PMAA单体的所有官能团
b.能与新制银氨溶液反应产生银镜
c.含有3种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
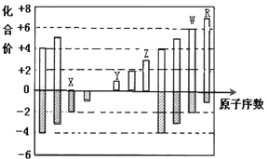
A. 原子半径:Z>Y>X
B. Y和Z两者最高价氧化物对应水化物能相互反应
C. WX3和水反应形成的化合物是离子化合物
D. 气态氢化物的稳定性:R<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示且与对应的叙述不相符的是( )

A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
B.图2表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
C.图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是![]()
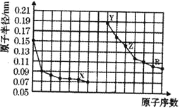
A.X、Y两种单质在常温下反应生成的产物为碱性氧化物
B.![]() 可由
可由![]() 和
和![]() 的溶液反应制取
的溶液反应制取
C.Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应
D.电解熔融的X与Z构成的化合物可以得到单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH![]() )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:![]() c(Na+)=c(CO
c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是合成某新型药物的中间体,下图是合成 G的部分流程:
已知:

乙酸酐的结构简式为![]()
请回答下列问题:
(1)G 中含氧官能团的名称是_______、________。
(2)反应 A→B 的化学方程式为________________。
(3)有机物 F的结构简式为_________________。
(4)反应 ④、⑤的反应类型分别是_________、___________。
(5)写出满足下列条件的 C 的同分异构体的结构简式______________________。
Ⅰ.苯环上只有两种取代基
Ⅱ.分子中只有 4 种不同化学环境的氢原子
Ⅲ.能与NaHCO3溶液反应生成 CO2
(6)以乙酸酐和![]() 为原料,制备
为原料,制备![]() 的部分流程图如下。请结合相关信息和已学知识,将合成路线补充完整(无机试剂任选)。
的部分流程图如下。请结合相关信息和已学知识,将合成路线补充完整(无机试剂任选)。
![]() ______________
______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com