
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 ①硫酸铝可利用Al与硫酸的置换反应或复分解反应生成;
②小苏打可利用碳酸钠、水、二氧化碳反应生成;
③氯化亚铁可利用Fe与氯化铁反应生成氯化亚铁;
④氢氧化铜不能利用化合反应生成,只可利用复分解反应生成;
⑤氢氧化铁可利用氢氧化亚铁、氧气、水反应生成;
⑥磁性氧化铁为四氧化三铁,可利用Fe与氧气反应生成.
解答 解:①硫酸铝可利用Al与硫酸的置换反应或复分解反应生成;
②小苏打可利用碳酸钠、水、二氧化碳反应生成;
③氯化亚铁可利用Fe与氯化铁反应生成氯化亚铁;
④氢氧化铜不能利用化合反应生成,只可利用复分解反应生成;
⑤氢氧化铁可利用氢氧化亚铁、氧气、水反应生成;
⑥磁性氧化铁为四氧化三铁,可利用Fe与氧气反应生成,
则利用化合反应制得的有②③⑤⑥,共4种,
故选B.
点评 本题考查金属及化合物的性质,为高频考点,把握物质的性质、发生的反应等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HF可以用于刻蚀玻璃 | |
| B. | 用小苏打(NaHCO3)发酵面团制作馒头 | |
| C. | SO2具有漂白性,可用于漂白纸浆,也可以大量用于漂白食品 | |
| D. | 纯碱用于生产普通玻璃,也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究温度对产率的影响 实验②和③探究反应时间对产率的影响 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | 4:1 | |
| ④ | 398 | 4 | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式:H:Cl | |
| B. | S2-离子的电子层结构: | |
| C. | 质量数为18的氧元素的核素:${\;}_{8}^{18}$O | |
| D. | CO2的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$ +H2O +H2O | |
| B. | CH2=CH2+Br2→ | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH2+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用、制备有毒气体应在通风橱中进行,应有尾气吸收处理装置 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50 mL量筒中配制0.100 0 mol•L-1碳酸钠溶液 | |
| D. | 汞洒落后,应立即撒上硫粉,并打开墙下面的排气扇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
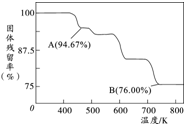 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com