(2010?浙江)已知:
①25℃时弱电解质电离平衡常数:K
a(CH
3COOH)=1.8×10
-5,K
a(HSCN)=0.13;难溶电解质的溶度积常数:K
sp(CaF
2)=1.5×10
-10②25℃时,2.0×10
-3mol?L
-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F
-)与溶液pH的变化关系,如图所示:
请根据以下信息回答下旬问题:
(1)25℃时,将20mL 0.10mol?L
-1CH
3COOH溶液和20mL 0.10mol?L
-1HSCN溶液分别与20mL 0.10mol?L
-1NaHCO
3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为:

反应初始阶段,两种溶液产生CO
2气体的速率存在明显差异的原因是
HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反映速率较快
HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反映速率较快
,反应结束后所得两溶液中,c(CH
3COO
-)
<
<
c(SCN
-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈
3.5×10-4
3.5×10-4
,列式并说明得出该常数的理由
K
a(HF)=
,当c(F
-)和c(HF)相等时,K
a(HF)=c(H
+),查图中的交点处即为c(F
-)=c(HF),故所对应的pH即为K
a(HF)的负对数
K
a(HF)=
,当c(F
-)和c(HF)相等时,K
a(HF)=c(H
+),查图中的交点处即为c(F
-)=c(HF),故所对应的pH即为K
a(HF)的负对数
.
(3)4.0×10
-3mol?L
-1HF溶液与4.0×10
-4 mol?L
-1 CaCl
2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.

 (2010?浙江)已知:
(2010?浙江)已知:


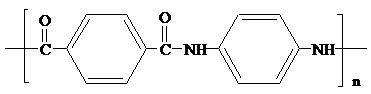 ,
,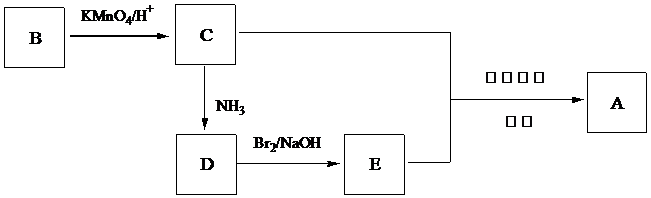
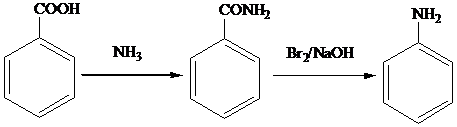


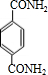

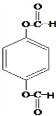

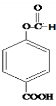



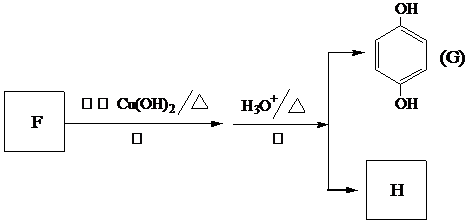




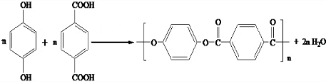


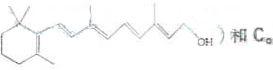 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.