
| 矿石名称 | 磁铁矿 | 黄铁矿 | 赤铁矿 | 黄铜矿 |
| 主要成分 | Fe3O4 | FeS2 | Fe2O3 | CuFeS2 |
 2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。
2Fe2O3+8SO2,该反应中被氧化的元素是 ,生成1molFe2O3转移电子的物质的量为 mol。 2Fe2O3+8SO2中,物质FeS2中Fe由+2价升到+3价;S由-1价升
2Fe2O3+8SO2中,物质FeS2中Fe由+2价升到+3价;S由-1价升

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源:不详 题型:实验题
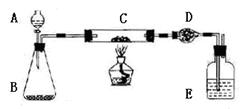
| 步骤 | 实验过程 | 实验现象 | 有关化学方程式 |
| 1 | |  | .com |
| 2 | 在C中加入样品W克,D中装入碱石 灰后并称量为m1克。连接好仪器,打开A的活塞,慢慢加溶液。 | | |
| 3 | 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: | | |
| 4 | 冷却后,称量D的质量为m2克。 |  |  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 (1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式 。
(1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式 。 (2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
(2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。| |
 (3)写出你所设计装置中的化学反应的方程式 。
(3)写出你所设计装置中的化学反应的方程式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若无铜析出,则溶液中有Cu2+、Fe2+,可能有Fe3+ |
| B.若有铜析出,则溶液中含有Fe2+,没有Cu2+和Fe3+ |
| C.若铁有剩余,则溶液中含有Fe2+,没有Cu2+和Fe3+ |
| D.若铁无剩余,则溶液中含有Fe2+,无Fe3+,可能含有Cu2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol铜片与含2 mol H2SO4的浓硫酸共热 |
| B.1 mol MnO2粉末与含2 mol H2O2的溶液共热 |
| C.常温下1 mol铝片投入足量的浓硫酸中 |
| D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3O4 | B.Fe2O3 | C.FeO | D.FeO和Fe3O4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.60 g | B.2.76 g | C.4.36 g | D.5.54 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com