

| n |
| 44 |
mg-
| ||
| mg |
m-
| ||
| m |
m-
| ||
| m |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ | ||||
| 阴离子 | OH- Cl- C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是有关钠与水反应及产物验证的改进实验装置.实验开始时先向管内加入滴有酚酞的水,使水位至B端管口,如图所示,迅速塞紧橡胶塞(此时活塞a是关闭的),使钠块掉入水中.回答下列问题:
如图是有关钠与水反应及产物验证的改进实验装置.实验开始时先向管内加入滴有酚酞的水,使水位至B端管口,如图所示,迅速塞紧橡胶塞(此时活塞a是关闭的),使钠块掉入水中.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
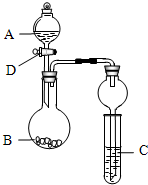 某同学设计了如图装置(夹持仪器省略)进行系列实验时,将药品A逐滴加入到固体B中,请根据下列实验回答问题.
某同学设计了如图装置(夹持仪器省略)进行系列实验时,将药品A逐滴加入到固体B中,请根据下列实验回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
 氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有一种元素组成的物质,一定是纯净物 |
| B、酸性氧化物一定都是非金属氧化物 |
| C、非金属元素组成的化合物一定含有共价键 |
| D、阴阳离子中均分别只含有一种元素,则由这样的阴阳离子组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe在氯气中燃烧生成FeCl2 |
| B、SiO2的化学性质不活泼,不与任何酸发生反应 |
| C、常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀 |
| D、铁粉中混有铝粉既可用过量的NaOH溶液,也可以用过量FeCl3溶液充分反应过滤除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com