
分析 (1)玻璃的成分中含有二氧化硅,属于酸性氧化物,可以和强碱之间发生反应;
(2)氯气有毒不能排放到大气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(3)铝是两性元素和强酸强碱发生反应,铝与碱反应生成偏铝酸盐和氢气;
(4)浓硫酸具有吸水性,可以吸收气体中的水蒸气,做气体干燥剂,常温下,铁、铝在浓硝酸、浓硫酸中发生钝化,不能继续发生反应.
解答 解:(1)玻璃塞中的SiO2会与碱液氢氧化钠反应生成具有黏性的硅酸钠,这样硅酸钠将瓶塞和瓶颈粘在一起了,不容易打开,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(2)氯气有毒不能排放到大气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(3)铝是两性元素和强酸强碱发生反应,铝与碱反应生成偏铝酸盐和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)浓硫酸具有吸水性,可以吸收气体中的水蒸气,做气体干燥剂,铁在常温下遇到浓硫酸或浓硝酸会发生钝化,表面生成一层致密的氧化膜阻止反应的进一步进行,所以生活中常用铝制或铁制的容器来运输或盛装浓硫酸或浓硝酸,
故答案为:吸水,常温下铁遇浓硫酸钝化.
点评 本题涉及化学在生活以及实验室中的应用知识,注意化学知识和实际的灵活应用,是现在考试的热点,掌握物质性质是解题关键,难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫、二氧化氮和二氧化碳的任意排放都会导致酸雨 | |
| B. | Na2O可用于呼吸面具中作为氧气的来源 | |
| C. | 向煤中加入适量生石灰,可大大减少燃烧产物中SO2的量 | |
| D. | 稀双氧水可作医疗消毒剂,说明H2O2对人体无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化铵
氯化铵 氢氧化钠
氢氧化钠
 ,二氧化碳
,二氧化碳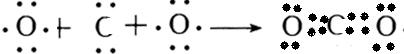
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 同一周期中,卤族元素的第一电离能最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中均存在共价键 | |
| B. | 晶体结构相似的原子晶体,共价键越弱,熔点越低 | |
| C. | 晶体在受热熔化过程中一定存在化学键的断裂 | |
| D. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,它的常见氢化物的空间结构为三角锥形,工业固氮制备该氢化物的原理(反应方程式)是N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3.
,它的常见氢化物的空间结构为三角锥形,工业固氮制备该氢化物的原理(反应方程式)是N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com