
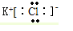 N2
N2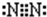 Na2O2
Na2O2 Mg3N2
Mg3N2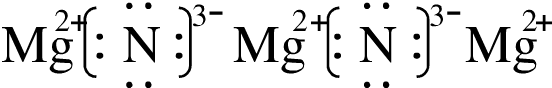
 .
. 分析 (1)首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
(2)二氧化碳为共价化合物,碳原子与两个氧原子分别共用2对电子.
解答 解:(1)KCl为离子化合物,由钾离子与氯离子构成,电子式为: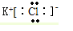 ;
;
氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为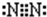 ;
;
Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
Mg3N2是离子化合物,由Mg2+离子和N3-离子构成,Mg3N2的电子式为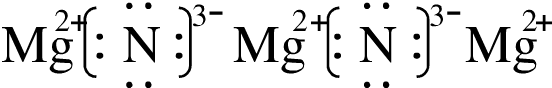 ;
;
故答案为: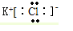 ;
;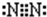 ;
; ;
;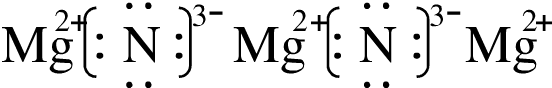
(2)二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为: ,
,
故答案为: .
.
点评 本题考查电子式的书写和用电子式表示形成过程,难度不大,掌握电子式的书写规则是关键,注意未成键的孤对电子对容易忽略.


科目:高中化学 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
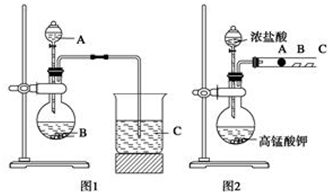
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

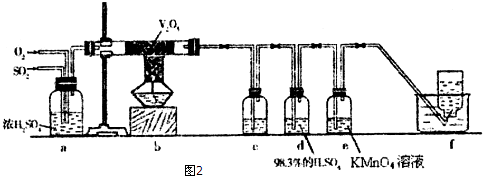
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体则$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 | |
| B. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | lmol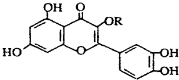 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | 红外光谱分析不能区分乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )分子的一氯代物有2种.
)分子的一氯代物有2种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和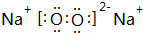 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com