
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
分析 A.NH4HCO3溶于过量的NaOH溶液,生成碳酸钠、一水合氨、水;
B.反应生成的次氯酸为弱电解质,离子方程式中次氯酸不能拆开;
C.离子方程式两边正电荷不相等,不满足电荷守恒;
D.亚硫酸钡被稀硝酸氧化成硫酸钡沉淀.
解答 解:A.NH4HCO3溶于过量的NaOH溶液,生成碳酸钠、一水合氨、水,正确的离子反应为:NH4++HCO3-+2OH-═CO32-+H2O+NH3•H2O,故A错误;
B.Cl2通入水中,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故B错误;
C.用氯化铁溶液腐蚀印刷线路板上的铜,反应生成氯化亚铁和氯化铜,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.亚硫酸钡固体中加入稀硝酸,二者发生氧化还原反应,反应的离子方程式为:3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,注意反应物过量情况对生成物的影响,试题侧重考查学生的分析能力及灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Z-+H2O═HZ+OH- | B. | HY+H2O═H3O++Y- | ||
| C. | 常温下,电离度:HX>HY>HZ | D. | HX+Z-→X-+HZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用其它试剂便无法区别NaCl、Na2CO3、NaHSO4、AlCl3四种溶液 | |
| B. | 实验室常用带玻璃塞的试剂瓶保存NaOH溶液 | |
| C. | 用导线将电解池和电池连接,电子从电池的负极流向电解池的阳极 | |
| D. | 用以下反应制取硫酸铜:2Cu+O2═2CuO、CuO+H2SO4=CuSO4+H2O符合绿色化学的理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁被氧化时,失去电子数目一定是2NA | |
| B. | 常温常压下,71g Cl2中含电子总数为34NA | |
| C. | 标准状况下,2.24L SO3中,含分子总数为0.1NA | |
| D. | CnH2n+2分子中含有共价键数为(3n+1)NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3含有的原子数为4NA | |
| B. | 78 g过氧化钠中含有的离子数为4NA | |
| C. | 过氧化钠与CO2反应生成32g O2,则反应转移的电子数为2NA | |
| D. | 密闭容器中,标准状况下22.4L SO2和11.2LO2 在加热、有催化剂的条件下充分反应,容器中的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
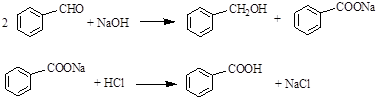
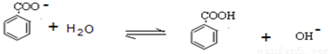 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
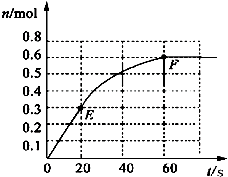 373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com