

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
分析 (1)仪器A是干燥管,因为TiCl4遇到水蒸气会水解,所以E中可以用浓硫酸来隔离空气;
(2)对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品,发生反应,终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2;
(3)分离两种沸点不同的液体混合物应该用蒸馏;D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,分离互溶的液体采取蒸馏方法;
(4)使用冰水混合物的目的是冷却TiCl4气体;
(5)盐类水解的实质是结合水电离出的氢离子和氢氧根离子生成弱电解质的过程,TiCl4 遇到湿空气发生强烈的水解,生成H2TiO3、HCl;
(6)根据97%的TiO210克以及TiO2(s)+2CCl4(g)→TiCl4(g)+CO2(g)计算出理论值,转化率=$\frac{实际产量}{理论产量}$.
解答 解:(1)仪器A是干燥管,因为TiCl4遇到水蒸气会水解,所以E中可以用浓硫酸来隔离空气中的水蒸汽,故答案为:干燥管;浓硫酸;
(2)对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品,发生反应,终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2;
故答案为:②③①;
(3)D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,但CCl4和TiCl4是两种沸点差异较大的液体混合物,应该用蒸馏进行分离,故答案为:蒸馏;
(4)在装置C中发生:TiO2(s)+2CCl4(g)→TiCl4(g)+CO2(g),为得到TiCl4,分离二氧化碳,使用冰水混合物将气态的TiCl4冷却,D中的液态混合物为TiCl4与未反应的CCl4,
故答案为:冷却TiCl4气体;
(5)TiCl4与水反应生成氯化氢和二氧化钛的水合物H2TiO3,反应的化学方程式:TiCl4+3H2O═H2TiO3↓+4HCl,故答案为:TiCl4+3H2O═H2TiO3↓+4HCl;
(6)97%的TiO210克,含有n(TiO2)=$\frac{m}{M}$=$\frac{10g×97%}{80g/mol}$=0.12125mol,TiO2(s)+2CCl4(g)→TiCl4(g)+CO2(g),理论产生TiCl4为:0.12125mol×190g/mol=23.0375g,最终得到19.8克的产品,则TiO2的转化率=$\frac{实际产量}{理论产量}$=$\frac{19.8g}{23.0375g}$×100%≈85.95%,故答案为:85.95%.
点评 本题考查实验制备方案,明确原理是解题关键,侧重考查学生装置的分析评价,注意对题目信息的提取与应用,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀~沉淀完全的pH | 2.7~4.1 | 3.7~5.2 | 7.5~9.6 | 8.6~10.1 | 9.6~11.1 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
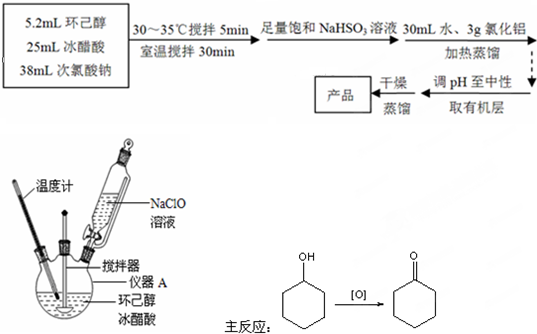
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0-10min内,用A表示的平均反应速率是0.05mol•L-1•min-1 | |
| B. | 0-10min内,用B表示的平均反应速率是0.01mol•L-1•min-1 | |
| C. | 分别用B、C、D表示反应的速率,其比值是4:3:1 | |
| D. | 随着反应的进行,容器内气体压强始终保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com