
分析 根据m=nM计算出二氧化碳的质量,然后计算出二者质量之比;根据n=$\frac{m}{M}$计算出氧气的物质的量,相同条件下气体的体积之比等于其物质的量之比;分子数之比等于其物质的量之比;结合SO2和SO3的分子组成计算出二者所含O原子的物质的量之比.
解答 解:0.2molCO2的质量为:44g/mol×0.2mol=8.8g,则4.8gO2和0.2molCO2的质量之比=4.8g:8.8g=6:11;在同温同压下的体积之比等于其物质的量之比,则二者体积之比=$\frac{4.8g}{32g/mol}$:0.2mol=3:4;相同物质的量的SO2和SO3,所含分子的数目之比等于其物质的量之比,则二者含有分子数之比为1:1,所含氧原子的物质的量之比=(1×2):(1×3)=2:3,
故答案为:6:11;3:4; 1:1;2:3.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题侧重基础知识的考查,培养了学生的化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
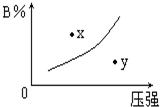 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | 只有① | B. | 只有②④ | C. | 只有①②④ | D. | 只有①和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | H2S+Cl2=S+2HCl | D. | Cu2O+H2SO4=CuSO4+Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | 3Cl2+6KOH=5KCl+KClO3+3H2O | |
| C. | 3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl | |
| D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加硝酸后的不溶性沉淀一定是BaSO4 | |
| B. | Na2SO3已部分被空气中的氧气氧化 | |
| C. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| D. | 此实验能确定Na2SO3是否被部分氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com