
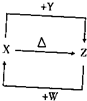
分析 X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,且X与Y反应也得到Z,W为无色气体,与Z反应得到X,可推知X为NaHCO3,Y为NaOH,Z为Na2CO3,W为CO2.
(1)氢氧化钠与碳酸氢钠反应生成碳酸钠与水;
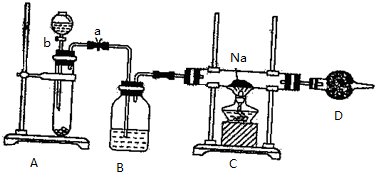
(2)①若不漏气,随液体加入,试管内压强增大,最后液体不能流下;
②A中制备氧气,可以是过氧化钠与水反应;
③C中生成过氧化钠,由钠离子与过氧根离子构成;
④过氧化钠能与空气中水蒸气、二氧化碳反应.
解答 解:X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,且X与Y反应也得到Z,W为无色气体,与Z反应得到X,可推知X为NaHCO3,Y为NaOH,Z为Na2CO3,W为CO2.
(1)氢氧化钠与碳酸氢钠反应生成碳酸钠与水,反应离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(2)①若不漏气,随液体加入,试管内压强增大,最后液体不能流下,而漏斗中液体不断地往下滴,直至全部流入试管,可以判断装置漏气,
故答案为:漏气;
②A中制备氧气,可以是过氧化钠与水反应,化学反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
③C中生成Na2O2,由钠离子与过氧根离子构成,阴阳离子个数比为1:2,
故答案为:1:2;
④过氧化钠能与空气中水蒸气、二氧化碳反应,需要用碱石灰吸收,防止加入C中,
故答案为:碱石灰;防止空气中的H2O、CO2进入C装置.
点评 本题考查无机物推断、化学实验等,涉及钠元素化合物的相互转化,要求学生对元素化合的知识非常熟练,把握常见气体的制备方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用无水硫酸铜可检验酒精中是否有水 | |
| B. | 加生石灰进行过滤,可除去酒精中的水 | |
| C. | 用酒精可萃取出碘水中的碘 | |
| D. | 医院用100%酒精进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2所含有的原子数目为NA | |
| B. | 0.5mol CO2含有的原子数目为1.5 NA | |
| C. | 1mol H2O含有的水分子数目为NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) 增大 | B. | Ka(HF)增大 | C. | $\frac{c({F}^{-})}{c({H}^{+})}$减小 | D. | $\frac{c({H}^{+})}{c(HF)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+、Na+、AlO2-、CO32- | B. | 二氧化硫:Na+、NH4+、SO32-、Cl- | ||
| C. | 氯化氢:H+、K+、MnO4-、SO42- | D. | 二氧化碳:Mg2+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com