
 Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.50 | 23.70 |
| 2 | 20.00 | 1.02 | 21.03 |
| 3 | 20.00 | 2.00 | 21.99 |
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度 (mol?L-1) | 体积 (mL) | 浓度 (mol?L-1) | 体积 (mL) | ||
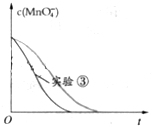
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| V(H2C2O4)?c(H2C2O4) |
| V(KMnO4) |
| 2 |
| 5 |
| (21.03-1.02)mL+(21.99-2.00)mL |
| 2 |
| 2 |
| 5 |
| 5 |
| 2 |
| 0.010mol/L×0.004L |
| 0.002L+0.004L |
| 2 |
| 3 |
| ||
|
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3和氨水 |
| B、Na2CO3和稀盐酸 |
| C、NaCl和AgNO3 |
| D、盐酸和NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| KMnO4酸性溶液的浓度/mol?L-1[学|科| | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
| 实验编号 | 20℃下,试管中所加试剂及其用量/mL | 20℃下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 4 | 4.0 | 1.0 | 3.0 | 2.0 | 4.0 |
| 5 | 2.5 | 2.5 | 3.0 | 2.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① |
| B、只有③ |
| C、①②③的混合物 |
| D、①②③④的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
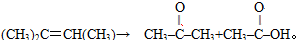 现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和
现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和 请写出该烯烃分子发生加聚反应的化学方程式
请写出该烯烃分子发生加聚反应的化学方程式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com