
| A. | 由铝土矿冶铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| B. | 制硫酸:硫铁矿$→_{空气}^{高温}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| C. | 由NaCl制漂白粉:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| D. | 合成氨:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
分析 A.铝土矿主要成分是三氧化二铝;
B.应将二氧化硫转化为三氧化硫,然后与水反应生成生成硫酸;
C.氯气与石灰乳反应生成漂白粉;
D.工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气.
解答 解:A.铝土矿主要成分是三氧化二铝,应提纯后再电解,故A错误;
B.硫铁矿燃烧生成二氧化硫,应将二氧化硫转化为三氧化硫,然后与水反应生成生成硫酸,故B错误;
C.电解氯化钠生成氯气,氯气与石灰乳反应生成漂白粉,故C正确;
D.工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,实验室常用氯化铵固体与碱石灰固体共热来制取氨气,故D错误.
故选C.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
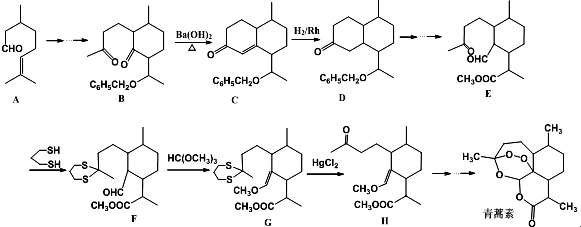
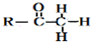 +
+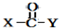 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$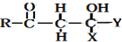
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
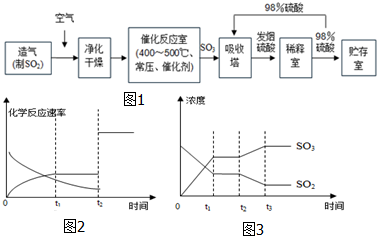
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
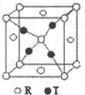 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题: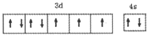 .
.| 电负性 | 原子半径 | 沸点 | 酸性 |
| Y<Z | Z>R | Y2X6<YX4R | XZR3>XZR2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若含X的混合物为溴水,可通过方案Ⅰ进行分离,加入试剂为CCl4溶液,充分振荡后液体分层,下层为X的CCl4溶液 | |
| B. | 若含X的混合物为BaSO4、BaSO3的混合物,可通过方案Ⅱ进行分离得到X,加入试剂为稀硝酸,X为BaSO4 | |
| C. | 若含X的混合物为乙醇和乙酸乙酯的混合物,可通过方案Ⅰ进行分离,加入试剂为饱和NaOH溶液,残留液中含有乙酸钠 | |
| D. | 若含X的混合物为Fe、Al,可通过方案Ⅱ进行分离,加入的试剂是过量的NaOH溶液,1molX与足量氯气完全反应时,转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后在光照的条件下发生反应 | |
| B. | 甲苯与Br2发生反应 | |
| C. | 乙炔与氢气的加成反应 | |
| D. | 乙烯与氯化氢的加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
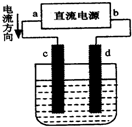
| A. | d为负极、c为正极 | B. | c电极上发生还原反应有气体产生 | ||
| C. | 电解过程中,氯离子向d电极移动 | D. | 电解过程中,d电极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ① | C. | ④ | D. | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com